
����Ŀ����Է�������Ϊ92��ij������X��һ����Ҫ���л�����ԭ�ϣ��о���������Ϊ��ʼԭ����Ƴ�����ת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ��������A��һ�ȴ��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO��
��֪��
�� ![]()
�� ![]()
�������ѧ֪ʶ�뱾��������Ϣ�ش��������⣺
��1��X�ķ������������ԭ�ӹ��森
��2��H�Ľṹ��ʽ�� ��
��3����Ӧ�ۡ��ܵ��������� ��
��4����Ӧ�ݵĻ�ѧ����ʽ�� ��
��5��![]() �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ����Һ˴Ź���������ʾΪ6���ķ����廯���ﹲ���֣�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ����Һ˴Ź���������ʾΪ6���ķ����廯���ﹲ���֣�
��6�����úϳɷ�Ӧ����ͼ��ʾ����A����������ܼ���ѡ���ϳ� ![]() ������ķ����� ʾ�����£�
������ķ����� ʾ�����£�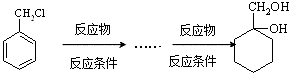
���𰸡�
��1��13
��2��
��3����ԭ��Ӧ�����۷�Ӧ
��4��
��5��4
��6��
���������⣺��Է�������Ϊ92��ij������X��һ����Ҫ���л�����ԭ�ϣ���������ΪCxHy���� ![]() =7��8����������Cԭ����Hԭ�ӹ�ϵ��֪��������Cԭ����Ŀ����С��7���ʸ÷�����X�ķ���ʽΪC7H8���ṹ��ʽΪ
=7��8����������Cԭ����Hԭ�ӹ�ϵ��֪��������Cԭ����Ŀ����С��7���ʸ÷�����X�ķ���ʽΪC7H8���ṹ��ʽΪ ![]() ��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ
��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ ![]() ��BΪ
��BΪ ![]() ��CΪ
��CΪ ![]() ��D�ữ����E����DΪ
��D�ữ����E����DΪ ![]() ��EΪ
��EΪ ![]() ��
�� ![]() ��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ
��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F����Ϸ�Ӧ�۵IJ����֪FΪ ![]() ��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ
��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ ![]() ��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO����
��H��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO���� ![]() �ķ���ʽ��ȼ���1����H2O��Ϊ
�ķ���ʽ��ȼ���1����H2O��Ϊ ![]() ͨ���γ��ļ��������۷�Ӧ���ɸ߾���HΪ
ͨ���γ��ļ��������۷�Ӧ���ɸ߾���HΪ  ����1����������ķ�����֪��X�ṹ��ʽΪ
����1����������ķ�����֪��X�ṹ��ʽΪ ![]() �������ϵ�����ԭ�Ӷ����Թ��棬����������ת������
�������ϵ�����ԭ�Ӷ����Թ��棬����������ת������ ![]() ����������� 13��ԭ�ӹ��棬���Դ��ǣ�13����2��������������֪��H�Ľṹ��ʽ��
����������� 13��ԭ�ӹ��棬���Դ��ǣ�13����2��������������֪��H�Ľṹ��ʽ��  �����Դ��ǣ�
�����Դ��ǣ�  ����3��������������֪����Ӧ����
����3��������������֪����Ӧ���� ![]() ��Fe/HCl�����·�����ԭ��Ӧ����
��Fe/HCl�����·�����ԭ��Ӧ���� ![]() ����Ӧ����
����Ӧ���� ![]() ͨ���γ��ļ��������۷�Ӧ���ɸ߾���H�����Դ��ǣ���ԭ��Ӧ�����۷�Ӧ����4����Ӧ����CΪ
ͨ���γ��ļ��������۷�Ӧ���ɸ߾���H�����Դ��ǣ���ԭ��Ӧ�����۷�Ӧ����4����Ӧ����CΪ ![]() ��������Һ����������Ӧ����
��������Һ����������Ӧ���� ![]() ����Ӧ����ʽΪ��
����Ӧ����ʽΪ��  ���Դ��ǣ�
���Դ��ǣ�  ����5��
����5��  �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯����û�����Ϊ��������γɵ���������˴Ź���������ʾΪ6��壬��2����OH���ڣ���CHO��2��λ�ã���2����OH��䣬��CHO��1��λ�ã���2����OH��ԣ���CHO��1��λ�ã��ʹ���4�֣�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯����û�����Ϊ��������γɵ���������˴Ź���������ʾΪ6��壬��2����OH���ڣ���CHO��2��λ�ã���2����OH��䣬��CHO��1��λ�ã���2����OH��ԣ���CHO��1��λ�ã��ʹ���4�֣�
���Դ��ǣ�4����6�� ![]() �ڴ��������·����ӳɷ�Ӧ����
�ڴ��������·����ӳɷ�Ӧ���� ![]() �������������ƴ���Һ�����������·�����ȥ��Ӧ����
�������������ƴ���Һ�����������·�����ȥ��Ӧ���� ![]() �������������ӳɷ�Ӧ����
�������������ӳɷ�Ӧ���� ![]() ���������������ˮ��Һ�з���ˮ�ⷴӦ����
���������������ˮ��Һ�з���ˮ�ⷴӦ���� ![]() ���ϳɷ�Ӧ����ͼΪ��
���ϳɷ�Ӧ����ͼΪ�� 
���Դ��ǣ�  ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�����������˵����ȷ���ǣ� ��
A. �ڳ��³�ѹ�£�11��2 LN2���еķ�����Ϊ0��5 NA
B. �ڳ��³�ѹ�£�1molNe���е�ԭ����ΪNA
C. 71gCl2����ԭ����ΪNA
D. ��ͬ�¡�ͬѹ�£���ͬ������κ����嵥��������ԭ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A. ����Һ��һ������ֱ��С��1 nm������
B. ����ˮ��������һ�ַ�ɢϵ
C. ��ɢϵ�е��Ǵ�����е��ǻ����
D. ʳ����Һ���ú��ֲ㣬�²���ϲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ǻϳ��������������в��ϩ�����������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ� 
�Ʊ��������װ��ʾ��ͼ��ͼ�����Ⱥͼг�װ�õ��ԣ���
��֪����������۵�Ϊ76.5�棬������ˮ�������Ҵ���
�ش��������⣺
��1����250mL����ƿa�м���70mL 70%���ᣬ���ƴ�����ʱ����������ˮ��Ũ������Ⱥ�˳������
��2����a�е���Һ������100�棬�����μ�40g�����浽������Һ�У�Ȼ��������130�������Ӧ����װ���У�����b��������������c�������� �� �������� �� ��Ӧ�������������ˮ���ٷ�����������Ʒ��������ˮ��Ŀ���� �� ���������п����ڷ��뱽�����Ʒ���������ţ� A����Һ©�� B��©�� C���ձ� D��ֱ�������� E��������
��3���ᴿ������ķ����� �� ���յõ�44g��Ʒ��������IJ�������
��4����CuCl22H2O��NaOH��Һ�Ʊ�����Cu��OH��2�����������������ˮϴ�ӳ������жϳ���ϴ�ɾ���ʵ���������������
��5������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ��������� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������в�������������������(����)
A.�������Ȼ�̼
B.�ƾ�������
C.�Ȼ�狀�����茶���
D.�������ع���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���飮
��1����֪��CO��g��+H2O��g��H2��g��+CO2��g����H=��41kJmol��1C��s��+2H2��g��CH4��g����H=��73kJmol��1
2CO��g��C��s��+CO2��g����H=��171kJmol��1
��ҵ�Ͽ���ú����Ȼ���������������ж���;������CH4 �� д��CO��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽ ��
��2����Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ ��
��3������Ȼ����ȡH2��ԭ��Ϊ��CO2��g��+CH4��g��2CO��g��+2H2��g�������ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��CH4��CO2 �� ��һ�������·�����Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ1��ʾ����ѹǿP1P2������ڡ���С�ڡ�����ѹǿΪP2ʱ����Y�㣺v������v���棩������ڡ�����С�ڡ����ڡ�������Y���Ӧ�¶��µĸ÷�Ӧ��ƽ�ⳣ��K= �� ��������������λ��Ч���֣�
��4���Զ������ѱ��渲��CuAl2O4 Ϊ���������Խ�CH4��CO2ֱ��ת�������ᣮ���ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ2��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���� ��
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶������ܱ������з������·�Ӧ��2M��g��+N��g��2E��g������ʼʱֻ����2molE��g������ƽ��ʱ����������ѹǿ����ʼʱ������20%������ʼʱֻ����2molM��1molN�Ļ�����壬��ƽ��ʱM��ת����Ϊ�� ��
A.20%
B.40%
C.60%
D.80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1 mol/LNaOH��Һ�ζ�10mL 0.1mol/LH2A��Һ����Һ��pH��NaOH��Һ�������ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��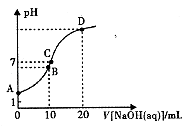
A.A����Һ�м�������ˮ�� ![]() ����
����
B.B�㣺c�� HA ������c��H+����c��A2-����c��H2A��
C.C�㣺c��Na+��=c��HA����+2c�� A2����
D.ˮ���������c��OH������B�㣾D��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com