
| A、两者pH相等 |
| B、盐酸pH大. |
| C、醋酸pH大 |
| D、pH均增大到4 |
科目:高中化学 来源: 题型:
| pH | c(CrO42-) | c(HCrO4-) | c( Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
| A、铬酸的第一步电离是完全电离 |
| B、铬酸的第二步电离是部分电离,且存在两种电离方式 |
| C、pH越大,电离出的CrO42-浓度越大 |
| D、溶液中存在2HCrO4-?Cr2O72-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B、无色澄清溶液:MnO4-、SO42-、K+、Fe3+ |
| C、能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D、能使石蕊试液变蓝色的溶液:HCO3-、NH4+、Cl?、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、NaOH |
| C、AgNO3 |
| D、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热情况下 |
| B、加压条件下 |
| C、通直流电情况下 |
| D、常温常压下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下,0.0lmol/L醋酸溶液的pH=4 |
| B、该温度下,用0.1mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 |
| C、该温度下,0.01mol/L醋酸溶液中由水电离出的c(H+)=10-11mol/L |
| D、该温度下,0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液中c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
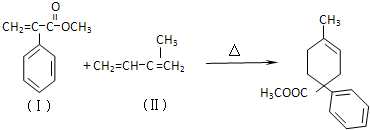
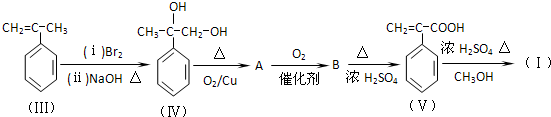
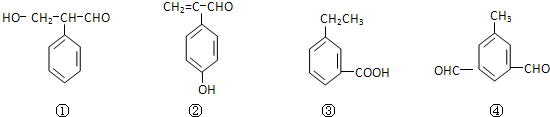
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com