
| A. | Fe2+(Fe3+):加KSCN溶液后过滤 | |
| B. | CO(H2):让气体通过赤热的氧化铜 | |
| C. | C2H4(C2H2):与H2加成 | |
| D. | Cl2(HCl):通过饱和氯化钠水溶液洗涤后收集 |
分析 A.Fe3+与KSCN反应生成Fe(SCN)3,溶于水;
B.二者都与氧化铜反应;
C.易引入新杂质;
D.氯气不溶于饱和食盐水.
解答 解:A.Fe3+与KSCN反应生成Fe(SCN)3,溶于水,用过滤的方法不能除去杂质,应加入铁粉除杂,故A错误;
B.二者都与氧化铜反应,不能用于除杂,故B错误;
C.不能确定乙烯的量,易引入新杂质,且在催化剂的条件下进行,实验室难以完成,故C错误;
D.氯气不溶于饱和食盐水,可用饱和食盐水除杂,故D正确.
故选D.
点评 本题考查物质分离、提纯,明确物质的性质是解本题关键,利用物质性质的差异性选取合适的试剂、分离方法进行除杂、分离,难点是除杂剂的选取,不能引进新的杂质还要考虑操作是否简便,易错选项是C.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
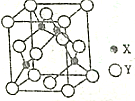 已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:
已知常见元素X的原子序数比常见元素Y的小,X的氢化物能与其最高价氧化物的水化物发生化合反应生成一种离子化合物M,Y元素的周期序数等于最外层电子数.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=0.2a | B. | b=0.3a | C. | b=0.25a | D. | a=2b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com