
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
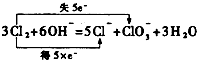 ,
,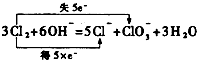 ;
;| 1 |
| 6 |


科目:高中化学 来源: 题型:
| 所需数据取值范围 | 生成CO2气体的体积 | |
| 盐酸不足量时 | ||
| 盐酸足量时 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或操作 | 解释及结论 | |
| A | 将胆矾放入坩埚中加热脱水,晶体由蓝色变 为白色 | 胆矾晶体易失结晶水 |
| B | 苯酚中滴加溴水有白色沉淀 | 苯酚与溴发生了加成反应 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白 色沉淀生成 | 说明该溶液中含有SO42- |
| D | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支 管口 | 此位置指示的是被蒸馏物质的沸 点 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23 g钠在氧气中完全燃烧失去电子数为NA |
| B、标准状况下,22.4L已烷所含碳原子数为6NA |
| C、20℃、1.01×105Pa时,1.6gC2H4和1.2g CO的混合气体,含气体分子数为0.1NA |
| D、0.1L 3mol?L-1的Al2(SO4)3溶液中含有的Al3+数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B、充电时阴极反应为:Fe(OH)3-3e-+5 OH-═FeO42-+4H2O |
| C、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| D、充电时阳极附近溶液的碱性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com