

分析 (1)根据反应方程式中生成物确定实验现象;
(2)减压蒸馏能分离出沸点较低的物质;
(3)抽滤需要用到的主要仪器有布氏漏斗和吸滤瓶;
(4)沸石有防止暴沸的作用;
(5)对苯二甲酸钠和盐酸能反应;
(6)利用丙酮作洗涤剂易于干燥.
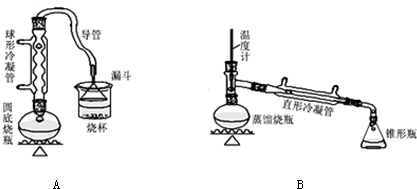
解答 解:(1)根据方程式知,饮料瓶碎片逐渐和碳酸氢钠反应生成二氧化碳,所以看到的现象是固体溶解,有气泡产生,
故答案为:固体溶解,有气泡产生;
(2)乙二醇熔沸点较低,减压蒸馏,有利于乙二醇分离,反应后溶液中含有对苯二甲酸钠和乙二醇,减压蒸馏可得乙二醇,
故答案为:乙二醇;
(3)抽滤需要用到的主要仪器有布氏漏斗和吸滤瓶,
故答案为:布氏漏斗、吸滤瓶;
(4)沸石的作用是防止液体剧烈沸腾,溅出液体而产生安全事故,所以加入沸石的目的是防止暴沸,
故答案为:防止暴沸;
(5)对苯二甲酸钠和盐酸能反应生成对苯二甲酸,从而实现实验目的,盐酸酸化的目的是将对苯二甲酸钠转化为对苯二甲酸,
故答案为:将对苯二甲酸钠转化为对苯二甲酸;
(6)丙酮具有挥发性,便于干燥,
故答案为:丙酮易挥发,有利于干燥.
点评 本题考查对苯二甲酸的制备实验,考查考生对实验中现象的分析、仪器的作用及操作目的分析能力.难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | FeCl3 | D. | Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| B. | 向FeI2溶液中通入适量C12,当有1mol1Fe2+被氧化时,共转移的电子的数目为3NA | |
| C. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| D. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2KMnO4$\stackrel{△}{→}$
=2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| 序号 | 实验方案 | 试验现象 | 结论 |
| ① | 将白色固体B加入水中,加热 溶解,冷却过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中, 滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化, 测得熔点 | 测得熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ②⑤⑥ | C. | ④⑤ | D. | ③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com