
| A、1s22s22p63s23p2→1s22s22p63s23p1 |
| B、1s22s22p63s23p3→1s22s22p63s23p2 |
| C、1s22s22p63s23p4→1s22s22p63s23p3 |
| D、1s22s22p63s23p1→1s22s22p63s2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | ||||
| B、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | ||||
| C、氯化铝溶液加入氨水:Al3++3OH-═Al(OH)3↓ | ||||
D、用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
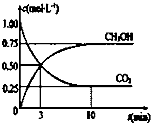 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 出现环境 | 实验事实 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 用惰性电极电解CuCl2溶液 | 在阳极有红色固体物质析出 |
| C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D | 将钢闸门与外加电源正极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、镀锌的铁比镀锡的铁耐用 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、铝片不用特殊方法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3=Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: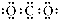 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com