
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
分析 氢氧化钙和少量二氧化碳反应生成碳酸钙的反应为Ca(OH)2+CO2═CaCO3↓+H2O,二氧化碳过量时碳酸钙部分溶解,发生反应为CaCO3+H2O+CO2═Ca(HCO3)2,
A.当二氧化碳不足时,只发生反应Ca(OH)2+CO2═CaCO3↓+H2O,据此计算出生成二氧化碳的质量;当二氧化碳稍过量时,发生反应Ca(OH)2+CO2═CaCO3↓+H2O、CaCO3+H2O+CO2═Ca(HCO3)2,据此计算出生成二氧化碳的质量;
B.氧化铜和碳反应的化学方程式及其质量关系为:
2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
128 44
分别根据二氧化碳为11g、33g计算出滤渣中的红色物质的质量;
C.2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
160 44
分别根据二氧化碳为11g、33g计算参与反应的氧化铜的可能质量;
D.不知剩余氧化铜的质量,无法判断稀硫酸中的溶质质量.
解答 解:氢氧化钙和二氧化碳反应生成碳酸钙的反应为:Ca(OH)2+CO2═CaCO3↓+H2O,二氧化碳过量时碳酸钙部分溶解,反应的化学方程式为:CaCO3+H2O+CO2═Ca(HCO3)2,
A.如果二氧化碳不足,碳酸钙是25g,根据反应可知生成二氧化碳的质量为:25g×$\frac{44}{100}$=11g;
如果二氧化碳过量,37g氢氧化钙和二氧化碳反应生成50g碳酸钙沉淀,然后过量的二氧化碳溶解(50-25)g=25g碳酸钙,则总共消耗二氧化碳的质量为:$\frac{37}{74}$×44g+$\frac{25}{100}$×44g=33g,故A正确;
B.氧化铜和碳反应的化学方程式及其质量关系为:
2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
128 44
如果生成的一氧化碳是11g时,根据氧化铜和碳反应的化学方程式可以计算出生成的铜的质量是32g,如果生成的二氧化碳是33g时,根据氧化铜和碳反应的化学方程式可以计算出生成的铜的质量是96g,故B正确;
C.2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
160 44
如果生成的一氧化碳是11g时,根据氧化铜和碳反应的化学方程式可以计算出反应的氧化铜的质量是40g,如果生成的一氧化碳是33g时,根据氧化铜和碳反应的化学方程式可以计算出反应的氧化铜的质量是120g,故C正确;
D.由于不知剩余氧化铜的质量,因此无法判断稀硫酸中的溶质质量,故D错误;
故选ABC.
点评 本题考查混合物反应的计算,题目浓度较大,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
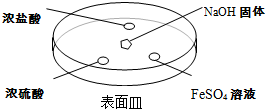
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水过程中不涉及化学变化 | B. | 金属与盐溶液反应都是置换反应 | ||
| C. | 化合反应一定有单质参加反应 | D. | 石油分馏和碘的升华都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
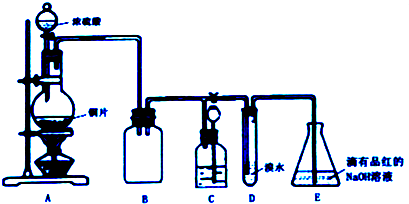
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
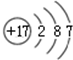 ②
②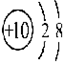 ③
③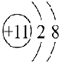 ④
④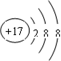
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com