
| A. | 用托盘天平称量25.20g NaCl | |
| B. | 用10mL量筒量取7.1mL稀盐酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热 |
分析 A.托盘天平的最小读数为0.1g,无法称量到0.01g;
B.10mL量筒的最小读数为0.1mL;
C.广泛pH试纸只能读出整数,无法读到0.1;
D.中和热的测定中,为了使测定结果更准确,一般需要使其中一种反应物过量.
解答 解:A.托盘天平只能读到0.1g,无法用托盘天平称量25.20g NaCl,故A错误;
B.10mL量筒可以读到0.1mL,可以用10mL量筒量取7.1mL稀盐酸,故B正确;
C.用广泛pH试纸测得某溶液的pH只能读到整数,无法读出2.3,可以用pH计,故C错误;
D.测定中和热时,为了使氢离子或者氢氧根离子完全反应,需要让其中一种反应物稍稍过量,不能用等体积、等浓度的氢氧化钠和盐酸测定中和热,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及化学实验基本操作方法的判断、常见计量仪器的构造及使用方法等知识,注意掌握常见的基本操作方法,明确常见化学仪器构造及正确使用方法;试题有利于提高学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
 X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):
X,Y,Z,R,W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列间题(相关回答均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
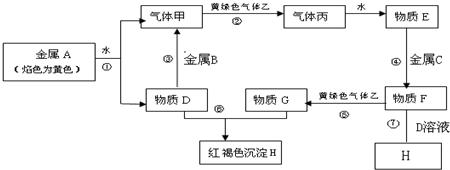
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的电子式: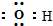 | |
| B. | F-的结构示意图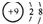 | |
| C. | N2的结构式: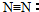 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:1:3 | C. | 2:5:2 | D. | 2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
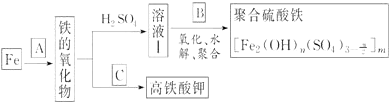
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com