
| A、①②③④ | B、④③②① |
| C、①③②④ | D、④②③① |
| y |
| 4 |
| 1 |
| 16 |
| y |
| 4 |
| 1 |
| 16 |
| 1 |
| 8 |
| 1 |
| 30 |
| y |
| 4 |
| 1 |
| 30 |
| 7 |
| 2 |
| 7 |
| 60 |
| 1 |
| 28 |
| y |
| 4 |
| 1 |
| 28 |
| 3 |
| 28 |
| 1 |
| 78 |
| y |
| 4 |
| 1 |
| 78 |
| 15 |
| 2 |
| 5 |
| 52 |


科目:高中化学 来源: 题型:
| +W |
| +W |
查看答案和解析>>
科目:高中化学 来源: 题型:
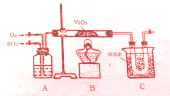 某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl- | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I- |
| B | 向澄清石灰水中通入少量CO2 气体 Ca2++2OH-+CO2=CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 气体 Ca2++2OH-+SO2=CaSO3↓+H2O |
| C | 向Na2CO3溶液中滴入稀HNO3 CO32-+2H+=CO2↑+H2O | 向Na2SO3溶液中滴入稀HNO3 SO32-+2H+=SO2↑+H2O |
| D | CO2通入漂白粉溶液中 CO2+Ca2++2ClO-+H2O=CaCO3↓+2HClO | SO2通入漂白粉溶液中 SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
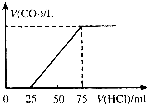 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
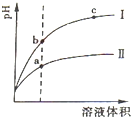 常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH
常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、体积和pH都相同的NH4Cl溶液、盐酸,完全溶解少量且等质量的锌粉,前者所用时间少 |
| C、将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-a mol?L-1,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com