
| A.0.1mol?L-1 | B.0.2mol?L-1 |
| C.0.05mol?L-1 | D.0.15mol?L-1 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.某反应低温条件下能自发进行,那么高温条件也一定能自发进行 |
| B.某反应高温条件下不能自发进行,那么低温条件也不能自发进行 |
| C.反应方向是由焓变和熵变共同决定的,与反应温度无关 |
| D.温度有可能对反应的方向起决定性的作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Z为0.3mol/L | B.Y为0.15mol/L |
| C.X为0.1mol/L | D.Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
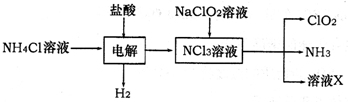
| ||
| . |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 (g)
(g) CO(g)+3H2(g)△H>0,达到平衡状态。下列叙述正确的是 ( )
CO(g)+3H2(g)△H>0,达到平衡状态。下列叙述正确的是 ( )| A.增加甲烷的量,上式中△H增大 |
| B.增大水蒸气的量,可提高水蒸气的转化率 |
| C.升高温度,逆反应速率增大,正反应速率减少 |
| D.增大体系压强,该反应的化学平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com