
| A. | ①②④⑤ | B. | ②③④⑤⑧ | C. | ②③④⑦⑧ | D. | 全部 |
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用铝热剂的反应,常用于冶炼高熔点的金属 | |
| B. | 氧化铝和铁的混合物是铝热剂 | |
| C. | 铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应 | |
| D. | 工业上常用铝热反应来大量冶炼金属铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物的减小或任何一种生成物的增加 | |
| B. | 化学反应速率0.8mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
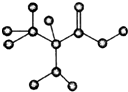 如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答:
如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com