
对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),下列说法中正确的是( )
2NH3(g)(正反应为放热反应),下列说法中正确的是( )
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小 |
| B.达到平衡后,升高温度,既加快了正、逆反应速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利用提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了 |
科目:高中化学 来源: 题型:单选题
在密闭容器中,一定条件下进行如下反应NO(g)+CO(g)
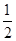 N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g),ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2 (g) 2NO2(g)
2NO2(g)
②2NO2(g) N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
| A.前5min反应的平均速率v(N2O4)=0.18mol·(L·min)-1 |
| B.T1℃时反应②的化学平衡常数K=0.6 |
| C.反应①、②均为吸热反应 |
| D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )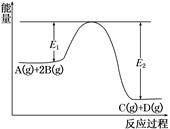
| A.该反应为吸热反应 |
| B.当反应达到平衡时,降低温度,A的转化率减小 |
| C.升高温度平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D.加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铜锌原电池(如图)工作时,下列叙述正确的是( )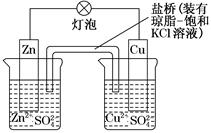
| A.正极反应为:Zn―→Zn2++2e- |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是( )
| A.焓变是一个反应能否自发进行相关的因素,多数放热反应能自发进行 |
| B.自发进行的反应一定能迅速进行 |
| C.在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D.一个反应能否自发进行,可用焓变和熵变共同判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高温下,某反应达平衡,平衡常数K=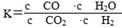 ,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O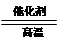 CO2+H2 CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )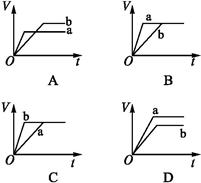
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
| A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压强一定时,熵增加的反应一定能自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程只与焓变有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com