
| A. | $\frac{a+b}{4}$ | B. | 4(3a+b) | C. | 4(a+b) | D. | $\frac{3a+b}{4}$ |
分析 先根据n=cV分别计算出硫酸铝、硫酸钾的物质的量,然后计算出混合液中含有硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出稀释后的溶液中SO42-的浓度.
解答 解:500mL a mol/L Al2(SO4)3溶液中含有硫酸根离子的物质的量为:amol/L×0.5L×3=1.5amol,
500mL钾离子浓度为2b mol/L的 K2SO4溶液中硫酸根离子的浓度为:2bmol/L×$\frac{1}{2}$=bmol/L,该溶液中含有硫酸根离子的物质的量为:bmol/L×0.5L=0.5bmol,则混合液中含有硫酸根离子的浓度为:c(SO42-)=$\frac{1.5amol+0.5bmol}{2L}$=$\frac{3a+b}{4}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,注意掌握稀释定律的内容及应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:2 | B. | 10:1 | C. | 11:1 | D. | 12:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000d×A%=C×M | B. | C=$\frac{1000dW}{(W+1000)M}$ | C. | S=$\frac{100W}{1000V}$ | D. | A%=[$\frac{W}{W+1000V}$]% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
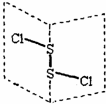 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
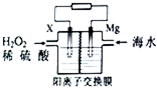 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )| A. | X可为铁、铜、石墨等电极,发生氧化反应 | |
| B. | 每转移2 mol电子,2molH+由交换膜左侧向右侧迁移 | |
| C. | 该电池能将化学能全部转化成电能 | |
| D. | 正极的电极反应式为比O2+2e-+2H+═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨⑩ | B. | ②③④⑦⑨⑩ | C. | ①③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com