
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
【制备FeBr2固体】
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将干燥、纯净的CO2气流通入D中,再将铁粉加热至600—700℃,E管中铁粉开始反应。不断将d中液溴滴入温度为100—120℃的D中,经过一段时间的连续反应,在不锈钢管内产生黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛有6 mol/L的盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中装有的试剂分别是:B中为____________,C中为_________________。
若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为_____________________。
(2)E管中的反应开始前通入CO2的主要作用是__________________________________;
E管中的反应开后持续通入CO2的主要作用是______________________________________。
【探究FeBr2的还原性】
(3)现实验需要90 mL 0.1 mol/L FeBr2溶液,取上述反应制得的FeBr2固体配制该溶液,所需仪器除烧杯、量筒、玻璃棒外,还需要的玻璃仪器是_______________________________。
(4)已知:Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色。Cl2既能氧化Br-,也能氧化Fe2+。
取10 mL上述FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。
以上实验结论表明还原性:Fe2+__________Br-(填“>”或“<”)。
(5)若在40 mL上述FeBr2溶液中通入标准状况下67.2 mL的 C12,取少量反应后的溶液加入CCl4,振荡后下层液体呈______色,写出该反应的离子方程式________________________________。
【答案】 饱和NaHCO3溶液 浓硫酸 3Fe+ 4H2O ![]() Fe3O4+ 4H2 排尽装置中原有的空气 将溴蒸气带入E装置中进行反应 胶头滴管、100mL容量瓶 > 橙红 4Fe2++2Br- +3Cl2 = 4Fe3++ Br2 + 6Cl-
Fe3O4+ 4H2 排尽装置中原有的空气 将溴蒸气带入E装置中进行反应 胶头滴管、100mL容量瓶 > 橙红 4Fe2++2Br- +3Cl2 = 4Fe3++ Br2 + 6Cl-
【解析】
(1)装置B用于除去二氧化碳中的氯化氢气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥;若进入E装置中的CO2未干燥,则可能发生的副反应的化学方程式为3Fe+ 4H2O ![]() Fe3O4+ 4H2溴蒸汽有毒,不能排到空气中,可被碱液吸收,如氢氧化钠溶液能够与溴单质反应,适宜为防止污染空气,实验时应在F处连接盛有碱液如氢氧化钠溶液的尾气吸收装置,故答案为:盛有饱和NaHCO3溶液的洗气瓶;盛有浓H2SO4的洗气瓶;NaOH溶液;
Fe3O4+ 4H2溴蒸汽有毒,不能排到空气中,可被碱液吸收,如氢氧化钠溶液能够与溴单质反应,适宜为防止污染空气,实验时应在F处连接盛有碱液如氢氧化钠溶液的尾气吸收装置,故答案为:盛有饱和NaHCO3溶液的洗气瓶;盛有浓H2SO4的洗气瓶;NaOH溶液;
(2)反应过程中要不断地通入CO2,其主要作用是为:反应前将容器中的空气赶净,避免空气中的氧气干扰实验;反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应,故答案为:①排净容器里的空气;②将Br2蒸气带入反应器E中;
Ⅱ.(3)配制90 mL 0.1 mol/L FeBr2溶液FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管,则除烧杯、玻璃棒 量筒、外还需的玻璃仪器是,胶头滴管、100ml的容量瓶;故答案为:100ml的容量瓶,胶头滴管;
(4).取10 mL上述FeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为血红色,证明有Fe3+。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体,实验证明不存在单质溴,
以上实验结论表明还原性:Fe2+>Br-。
(5)40 ml 0.1 mol/L FeBr2溶液含有FeBr2的物质的量为0.004mol,还原性Fe2+>Br-,二者以4:3反应,标准状况下67.2 mL的 C12的物质量为0.003mol ,转移电子0.003![]() =0.006mol由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化为Br2,所以加入CCl4,振荡后下层液体呈橙色,反应的离子反应为4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,故答案为:橙色 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。
=0.006mol由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化为Br2,所以加入CCl4,振荡后下层液体呈橙色,反应的离子反应为4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,故答案为:橙色 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-。


科目:高中化学 来源: 题型:
【题目】下列哪种溶液中氯离子的物质的量浓度与50mL 0.5mol/L的氯化铝溶液中氯离子的物质的量浓度相同( )
A. 30mL 0.5mol/L的氯化镁溶液 B. 60mL 1.5mol/L的氯化钠溶液
C. 20mL 0.1mol/L的氯化钾溶液 D. 90mL 0.075mol/L 的氯化钙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B=C的反应速率方程为v=kc(A)·c(B),v为反应速率,k为反应速率常数,是温度的函数。当c(A)=c(B)=1 mol·L-1时,反应速率在数值上等于其反应速率常数。下列说法正确的是( )
A.只增大c(A)时,v增大
B.只增大c(C)时,v增大
C.只升高温度时,k不变
D.只升高温度时,k减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物.萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等). 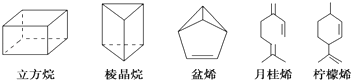
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色;
②棱晶烷、盆烯与苯互为同分异构体;
③月桂烯、柠檬烯互为同分异构体;
④立方烷、棱晶烷是环烷烃的同系物.
A.①②③
B.①②④
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃).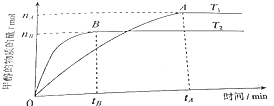
判断该可逆反应达到化学平衡状态的标志是(填字母).
①.v生成(CH3OH)=v消耗(CO2) ②.混合气体的密度不再改变
③.CO2、H2、CH3OH的浓度均不再变化 ④.混合气体的压强不再改变
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为 . 理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH3的摩尔质量为__________,3.4g NH3的物质的量为__________mol,该气体在标准状况下的体积为___________L。
(2)相同质量的O2和SO2,所含分子的数目之比为_____________,所含氧原子的物质的量之比为______________。
(3)实验室需要0.10 mol/L的硫酸980mL,某同学欲用密度为1.84 g/cm![]() 、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为__________mL,若向容量瓶转移溶液时,有少量液体溅出,则会使所配制的溶液物质的量浓度___________(填“偏高”,“偏低”或“不变”)。
、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为__________mL,若向容量瓶转移溶液时,有少量液体溅出,则会使所配制的溶液物质的量浓度___________(填“偏高”,“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是( )
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3 B. N2
Al2O3 B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3 D. FeS2
Na2CO3 D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 氧化还原反应的本质是元素化合价的升降
B. 金属阳离子被还原后,一定得到金属的单质
C. 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来
D. 四氯化碳和水混合后,可用分液的方法来分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com