ĪĀŹŅĘųĢ嶞Ńõ»ÆĢ¼¼õÅŵÄŅ»ÖÖ·½·ØŹĒ£ŗ“ÓČ¼Ćŗµē³§»ņĢģČ»Ęųµē³§ÅÅ·ÅĘųÖŠ»ŲŹÕCO
2£¬ŌŁÓėCH
4ČČ½āĀƲśÉśµÄH
2·“Ӧɜ³ÉCH
3OH£®
CO
2£Øg£©+3H
2£Øg£©
CH
3OH£Øg£©+H
2O£Øg£©
£Ø1£©500”ꏱ£¬ŌŚĢå»żĪŖ1LµÄČŻ»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1molCO
2ŗĶ3molH
2£¬²āµĆCO
2ŗĶCH
3OH£Øg£©µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼1ĖłŹ¾£®
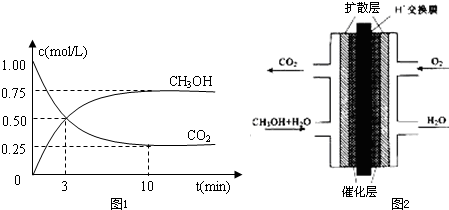
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØH
2£©=______mol?L
-1?min
-1£®
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=______£Ø±£ĮōŅ»Ī»Š”Źż£©£¬Ę½ŗāŹ±H
2µÄ×Ŗ»ÆĀŹĪŖ______£®
¢ŪŅŃÖŖĪĀ¶ČÉżøߣ¬KÖµ¼õŠ”£®ĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹
Ōö“óµÄŹĒ______£®
A£®ÉżøßĪĀ¶ČB£®³äČėHe£Øg£©£¬Ź¹ĢåĻµŃ¹ĒæŌö“ó
C£®½«H
2O£Øg£©“ÓĢåĻµÖŠ·ÖĄėD£®ŌŁ³äČė1molCO
2ŗĶ3molH
2£Ø2£©CH
3OH×÷ĪŖÄŚČ¼»śČ¼ĮĻ»ņĶعżČ¼ĮĻµē³ŲĒż¶Æ³µĮ¾£®æɼõÉŁCO
2ÅŷŶą“ļ45%£®
¢ŁŅŃÖŖ£ŗ
CH
3OH£Øg£©+H
2O£Øg£©ØTCO
2£Øg£©+3H
2£Øg£©”÷H
1=+49.0kJ?mol
-12H
2£Øg£©+O
2£Øg£©ØT2H
2O£Øg£©”÷H=-483.6kJ?mol
-1Ōņ·“Ó¦CH
3OH£Øg£©+
O
2£Øg£©ØTCO
2£Øg£©+2H
2£Øg£©µÄ”÷H=______kJ?mol
-1£®
¢Ś¼×“¼ÖŹ×Ó½»»»Ä¤Č¼ĮĻµē³ŲµÄ½į¹¹Ź¾ŅāĶ¼ČēĶ¼2£¬ŅŃÖŖH
+ŅĘĻņĶØČėO
2µÄµē¼«£¬¼×“¼½ųČė______¼«£ØĢī”°Õż”±»ņ”°øŗ”±£©£¬Õż¼«·¢ÉśµÄµē¼«·“Ó¦ĪŖ______£®