
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁 (填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色 沉淀产生. | 一定含铜. |
分析 (1)除铝处还含有铁、铜中的一种或两种;
(3)检验铁和铜,应先加入过量的氢氧化钠溶液,除去铝,然后在剩余固体中加入硫酸,溶液中生成氢气,且呈浅绿色,说明生成硫酸亚铁,说明含有铁,在反应后的溶液中加入硝酸,可将亚铁离子氧化生成铁离子,加入KSCN溶液,溶液变成血红色,最后剩余固体为铜,加入硝酸,铜溶解,最后加入氢氧化钠溶液可生成蓝色沉淀.
解答 解:(1)除铝处还含有铁、铜中的一种或两种,有三种情况:除铝外可能含有铁、铜或二者都有,
故答案为:Fe(或Cu);Cu(或Fe);
(3)检验铁和铜,应先加入过量的氢氧化钠溶液,除去铝,然后在剩余固体中加入硫酸,溶液中生成氢气,且呈浅绿色,说明生成硫酸亚铁,说明含有铁,在反应后的溶液中加入硝酸,可将亚铁离子氧化生成铁离子,加入KSCN溶液,溶液变成血红色,最后剩余固体为铜,加入硝酸,铜溶解,最后加入氢氧化钠溶液可生成蓝色沉淀,则设计实验可为:
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁(填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色 | 结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有 蓝色沉淀产生. | 一定含铜 |
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁(填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显 血红色 | 结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有 蓝色沉淀产生. | 一定含 铜. |
点评 本题考查了金属的性质以及实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度中等,注意把握性质的差异分析分离流程为解答的关键.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
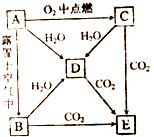 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
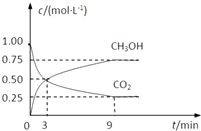 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
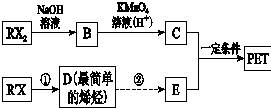 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%. .
.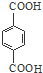 +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$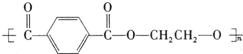 +2nH2O.
+2nH2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com