
| A. | 将纯水加热,其KW增大而PH不变 | |
| B. | 常温下,PH=6的溶液一定是酸溶液 | |
| C. | 25℃时,0.1mol/的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 向氨水中加入氯化铵固体会使溶液的pH增大 |
分析 A、水的电离平衡吸热;
B、常温下pH=6的溶液显酸性;
C、H2S为弱电解质,Na2S为强电解质;
D、氨水中存在电离平衡,加入氯化铵后,氨水的电离平衡左移.
解答 解:A、水的电离平衡吸热,故升高温度,水的电离平衡右移,则Kw增大,由于c(H+)增大,故pH减小,故A错误;
B、常温下pH=6的溶液显酸性,但不一定是酸溶液,还可能是强酸弱碱盐溶液,也可能是强酸的酸式盐溶液,故B错误;
C、H2S为弱电解质,Na2S为强电解质,故等浓度的H2S和Na2S溶液中,Na2S溶液中的离子浓度更大,故导电能力更强,故C正确;
D、氨水中存在电离平衡,加入氯化铵后,氨水的电离平衡左移,故c(OH-)减小,则pH减小,故D错误.
故选C.
点评 本题考查了电离平衡的移动和kw、pH的大小变化的判断,应注意的是纯水升高温度,Kw增大,pH变小,但永远显中性.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:多选题
| A. | 分子晶体中一定存在分子间作用力和共价键 | |
| B. | HF比HCl沸点高是因为HF分子间存在氢键 | |
| C. | 全部由非金属元素形成的化合物中可能含有离子键 | |
| D. | 溶于水能导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5g35Cl2气体的体积约为1.12L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的稳定性逐渐减弱 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | X、Y、Z三种化合物的熔、沸点逐渐降低 | |
| D. | 由A、B、C、D四种元素既能组成共价化合物又能组成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子半径X2+<W3+ | D. | 第一电离能X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
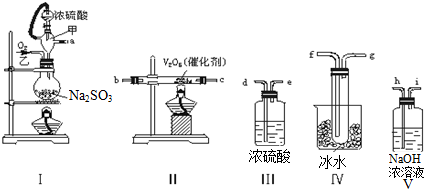
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
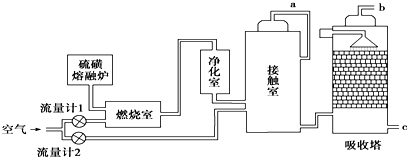
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com