
| A. | 合金 | B. | 农药 | C. | 半导体 | D. | 催化剂 |
分析 在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料.
解答 解:A.在元素周期表中,金属元素位于元素周期表的左下方,可以用来做导体,可以用来做合金等,像镁和铝等,故A不选;
B.非金属元素位于右上方,非金属可以制备有机溶剂,部分有机溶剂可以用来做农药,故B不选;
C.在金属元素和非金属元素交接区域的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故C选;
D.可以用于做催化剂的元素种类较多,一般为过渡金属元素,故D不选;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质及用途为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:计算题
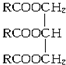 (R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键).0.1mol A与溶有96g Br2的四氯化碳溶液恰好完全反应.0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为 10.6mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+[:$\underset{\stackrel{••}{Cl}}{••}$:]2- | B. | Na+[$\stackrel{•}{X}$$\underset{\stackrel{••}{S}}{••}$$\stackrel{•}{X}$]-2Na+ | ||
| C. | [Mg2+][$\underset{X}{•}$$\underset{\stackrel{••}{O}}{••}$$\underset{X}{•}$]2- | D. | K+[$\stackrel{•}{X}$$\underset{\stackrel{••}{F}}{••}$:]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
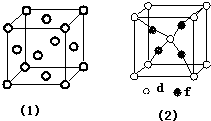 周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素a、b、c、d、e、f,原子序数依次增大.a是宇宙中最丰富的元素,b的某种核素在考古时用来测定一些文物的年代,d与e同族,用e氧化物漂白的草帽日久又变成黄色;f的最外层只有1个电子,但次外层有18个电子.回答下列问题;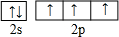 ,f在周期表中的位置是第四周期第IB族
,f在周期表中的位置是第四周期第IB族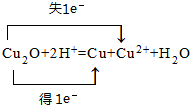 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | |
| B. | a molN-N键断裂的同时,有6a mol N-H键断裂 | |
| C. | 混合气体的密度不再随时间变化 | |
| D. | 单位时间生成m mol N2的同时消耗3m mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3、Fe2O3均为两性氧化物 | |
| B. | 该反应中化学能全部转化为热能 | |
| C. | Al2O3中的微粒半径:r(Al3+)>r(O2-) | |
| D. | 在该反应条件下,Al的还原性强于Fe的还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com