
有机化合物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项事实中,能说明上述观点的是( )
A.甲醛和甲酸都能发生银镜反应
B.乙烯能发生加成反应,而乙烷不能发生加成反应
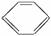
C.苯酚与溴水直接就可反应,而苯与溴反应则需要加铁屑
 D.苯酚和乙酸都可以与氢氧化钠反应
D.苯酚和乙酸都可以与氢氧化钠反应
科目:高中化学 来源: 题型:
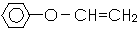 某有机物M( )是一种重要的化工原料,请回答下列问题:
某有机物M( )是一种重要的化工原料,请回答下列问题:
(1)M的分子式为_____________________。
(2)M与H2按物质的量比1:1反应的产物,不可能具有的性质是_________ (填序号)
A、易燃 B、难溶于水 C、可发生酯化反应
(3)某耐热型树脂R可由M和丙烯腈(CH2=CHCN)共聚而成。假定按1:1比例反应,试写出R的结构简式:________________________
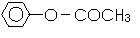 (4)以M为原料合成产品N( )的流程如下(条件略)
(4)以M为原料合成产品N( )的流程如下(条件略)
 |
则A的结构简式为________________________,
反应②的发生条件通常是________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_________,B为________,C为__________。(6分)
(2)E的电子式为_____________。(2分)
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:
_______________________________________________________。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:
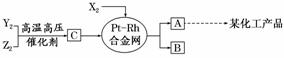
已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是_________________________________________。
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为________________________________。
(3)化合物B吸收C后形成的溶液pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)_______________________________________ __________。
(4)写出由C生成A和B的化学方程式______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种烃的一氯代物只有一种,则这种烃可能是( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有5个碳原子的烷烃 ④分子中具有8个碳原子的烷烃
A.①② B.②③
C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下合成路线,甲经二步转化为丙:
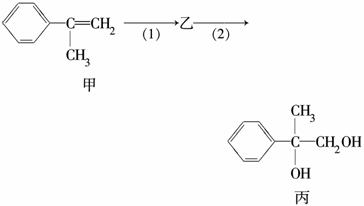
下列叙述错误的是( )
A.甲和丙均可与酸性KMnO4溶液发生反应
B.反应(1)的无机试剂是液溴,铁作催化剂
C.步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D.反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答:
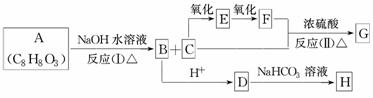
(1)写出下列化合物的结构简式:
A:________;B:________;G:________。
(2)C中的官能团名称为________。
(3)反应类型:(Ⅰ)________;(Ⅱ)________。
(4)写出D→H的化学方程式:____________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
)Heck反应是合成C—C键的有效方法之一,如反应①:
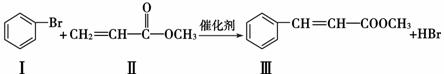
化合物Ⅱ可由以下合成路线获得:
Ⅳ(分子式C3H6O3)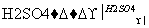 Ⅴ
Ⅴ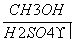 Ⅱ
Ⅱ
(1) 化合物Ⅲ的分子式为__________,1 mol化合物Ⅲ最多可与__________mol H2发生加成反应。
(2)化合物Ⅳ分子结构中有甲基,写出由化合物Ⅳ反应生成化合物Ⅴ的化学方程式
________________________________________________________________________
________________ ________________________________________________________。
________________________________________________________。
(3)有关化合物Ⅱ说法正确的 是( )
是( )
A.1 mol 化合物Ⅱ完全燃烧消耗5 mol O2
B.化合物Ⅱ能使酸性高锰酸钾溶液褪色
C.化合物Ⅱ难溶于水
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为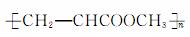
(4)化合物Ⅲ的一种同分异构体Ⅵ,苯环上的一氯取代物有两种,Ⅵ能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1∶1∶1∶3,Ⅵ的结构简式为________________________________________________________________________。
(5)CH3Ⅰ和O也可以发生类似反应①的反应,有机产物的结构简式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com