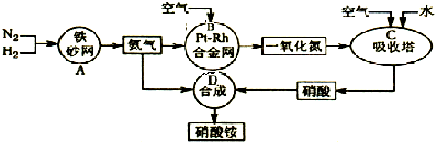
(2010?南通模拟)下列框图涉及到的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、E为无气体单质,D为红色金属单质,B为黑色氧化物(部分反应的产物未列全).
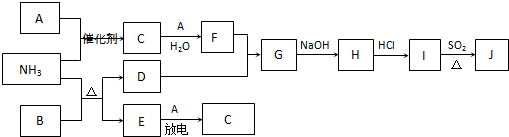
请回答下列问题:
(1)在NH
3与F等物质的量反应后的溶液中,离子浓度由大到小的顺序为
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.
(2)I、J是同种金属的氯化物,且J为白色沉淀.则SO
2还原I生成J的离子方程式为
2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-
2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-
.
(3)汽车尾气中常含有C.NH
3在加热和催化剂存在的条件下能消除C的污染.已知:
①4NH
3(g)+5O
2(g)?4NO(g)+6H
2O(g)△H=-905kJ?mol
-1 ②4NH
3(g)+3O
2(g)?2N
2(g)+6H
2O(g)△H=-1268kJ?mol
-1则NH
3与C反应的热化学方程式为
6NO(g)+4NH3(g)═5N2(g)+6H2O(g)△H=-1812.5 kJ?mol-1
6NO(g)+4NH3(g)═5N2(g)+6H2O(g)△H=-1812.5 kJ?mol-1
.
(4)有人认为:“表面化学”研究成果能使NH
3和C的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高.请你应用化学基本理论对此观点进行评价:
该研究只能提高化学反应速率,不能使化学平衡发生移动
该研究只能提高化学反应速率,不能使化学平衡发生移动
.



 快捷英语周周练系列答案
快捷英语周周练系列答案