
 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
 .
.分析 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大.C原子p轨道和s轨道中的电子数相等,则C核外电子排布为1s22s22p4或1s22s22p63s2,故C为氧元素或镁元素,C与非金属的原子结合时形成共价键,则C为非金属元素,故C为氧元素;B原子中成对电子数等于未成对电子数的2倍,原子序数小于氧,核外电子排布式为1s22s22p2,故B为碳元素;A的第一电离能低于同周期相邻元素,A处于ⅢA族或ⅥA族,故A为硼元素;D与A、B、C均不同周期,其一个单质分子中只有一个σ键,E处于ⅦA族,D与A、B、C均不同周期,而E的原子序数比所处周期中未成对电子数最多的元素大3,D只能处于的第三周期,故D为氯元素,E处于第四周期,未成对电子数最多的外围电子排布式为3d54s1,可推知E为外围电子排布式为3d74s2,故E为Co元素.
解答 解:A、B、C、D、E五种元素都是前36号元素,原子序数依次增大.C原子p轨道和s轨道中的电子数相等,则C核外电子排布为1s22s22p4或1s22s22p63s2,故C为氧元素或镁元素,C与非金属的原子结合时形成共价键,则C为非金属元素,故C为氧元素;B原子中成对电子数等于未成对电子数的2倍,原子序数小于氧,核外电子排布式为1s22s22p2,故B为碳元素;A的第一电离能低于同周期相邻元素,A处于ⅢA族或ⅥA族,故A为硼元素;D与A、B、C均不同周期,其一个单质分子中只有一个σ键,E处于ⅦA族,D与A、B、C均不同周期,而E的原子序数比所处周期中未成对电子数最多的元素大3,D只能处于的第三周期,故D为氯元素,E处于第四周期,未成对电子数最多的外围电子排布式为3d54s1,可推知E为外围电子排布式为3d74s2,故E为Co元素.
(1)上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:H-C≡C-H,
故答案为:H-C≡C-H;
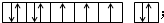
(2)E元素的元素符号:Co,其价电子排布图为: ,
,
故答案为:Co; ;
;
(3)A与D形成化合物的化学式为 BCl3,为平面正三角形结构,属于非极性分子,
故答案为:BCl3;非极性;
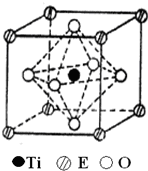
(4)晶胞中心的Ti原子与面向的6个O原子距离最近,E原子与面向的O原子距离最近,每个顶点为8个具备共用,每个面心为2个晶胞,1个E原子周围距离最近的O原子数目为$\frac{8×3}{2}$=12,
故答案为:6;12;
(5)N3-中N原子价层电子对数为$\frac{5+1-3×2}{2}$=0,价层电子对数为2+0=2,故为直线形,[Co(N3)(NH3)5]SO4中配体是NH3和N3-,Co的配位数是6,
故答案为:直线形;NH3和N3-;6.
点评 本题是对物质结构与性质的考查,推断元素是解题关键,涉及核外电子排布、分子结构与性质、晶胞计算、配合物等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8与C2H6互为同系物 | |
| B. | 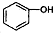 与 与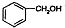 互为同系物 互为同系物 | |
| C. | 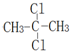 和 和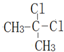 是同一种物质 是同一种物质 | |
| D. | 化学式为C5H10的有机物不一定能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的物质变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键强弱可决定分子晶体的熔、沸点高低 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | C3H8中碳原子都采用的是sp3杂化 | |
| D. | CO的一种等电子体为NO+,它的电子式为 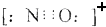 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 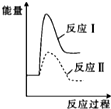 | C. | 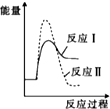 | D. | 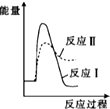 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
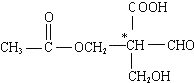 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )| A. | 与NaOH溶液共热 | B. | 与银氨溶液共热 | ||
| C. | 与金属钠反应 | D. | 与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
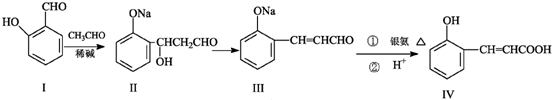
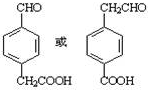 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com