
| A. | 0.1b/a mol•L-1 | B. | 1×10-1 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 0.1b/(a+b) mol•L-1 |
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素从上到下随核电荷数的增加,单质的熔沸点逐渐升高 | |
| B. | 第二周期元素(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7 | |
| C. | Se的氢化物应该比硫化氢稳定 | |
| D. | Sr的碳酸盐应该难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN的水溶液显碱性 | |
| B. | 1mol/L氢氰酸溶液的pH约为5 | |
| C. | 10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比盐酸溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵是量度混乱(或无序)程度的物理量 | |
| B. | 液态水变为气态水、氯化铵溶于水、扑克牌洗牌等均属于熵增的过程 | |
| C. | 焓增或熵减的过程均不能自发进行 | |
| D. | 过程的自发性只能用于判断过程的方向,不能确定过程是否发生和过程发生的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述反应中,只有一种元素被氧化 | |
| B. | 反应生成1molN2时,电子转移6mol | |
| C. | 还原产物与氧化产物的物质的量之比为1:3 | |
| D. | 在反应中高氯酸铵既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
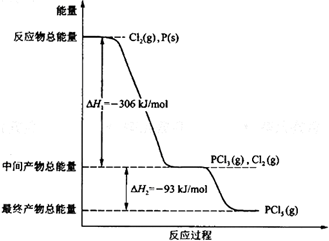 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.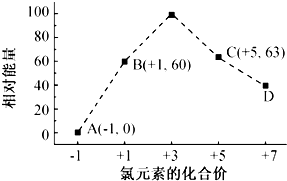
 ,…O-O-O…链状排列中中间氧的价态为0.
,…O-O-O…链状排列中中间氧的价态为0.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com