
分析 根据n=$\frac{V}{{V}_{m}}$计算出氯气的物质的量,然后利用电子守恒计算出被氧化的亚铁离子的物质的量,从而可计算出每份混合物中含有Fe的物质的量,然后计算出两份中含有铁的总质量;Fe不与氢氧化钠溶液反应,等量的Al在两个反应中生成氢气的量相等,设出每份中铝的物质的量,然后根据生成氢气的量列式计算出铝的物质的量,再计算出铝的质量即可.
解答 解:向混合物与盐酸反应所得溶液中通入标准状况下1.344L氯气,可使溶液中的40%Fe2+离子氧化,标准状况下13.44L氯气的物质的量为:$\frac{1.344L}{22.4L/mol}$=0.06mol,根据电子守恒,0.06mol氯气完全反应氧化Fe2+的物质的量为:n(Fe2+)=$\frac{0.06mol×2}{3-2}$=0.12mol,根据质量守恒可知每份混合物中含有Fe的物质的量为:$\frac{0.12mol}{40%}$=0.3mol,则原混合物中铁的质量为:56g/mol×0.3mol×2=33.6g;
根据反应Fe+2HCl=FeCl2+H2↑可知0.3molFe与盐酸完全反应放出氢气的物质的量为0.3mol,
设铝的物质的量为x,根据电子守恒可知等量的铝在两个反应中生成氢气的物质的量相等,都为$\frac{3}{2}$x,且相同条件下气体体积之比等于物质的量之比,则(0.3mol+$\frac{3}{2}$x):0.3mol=2:1,解得x=0.2mol,原混合物中铝的质量为:27g/mol×0.2mol×2=10.8g,
答:原混合物中含有Fe的质量为33.6g,含有Al的质量为10.8g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1 | |
| B. | 物质的量是指物质所含微粒的数目 | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 冰水混合物既是纯净物又是化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的H2O与D2O含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的镁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
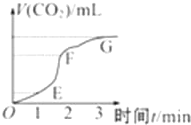 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
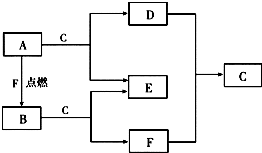 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com