
【题目】化学反应不仅有物质变化,同时还伴随着能量的变化,化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____。
(2)已知已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g液态水时放出的热量是__________ kJ(结果保留两位小数)
(3)已知热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2220 kJ/mol,2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
①现有H2和C3H8的混合气体共5mol,完全燃烧时放热3472.9kJ,则混合气体中H2和C3H8的体积比为__________。
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热_________ kJ。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol 25.96 3:1 4725.8
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol 25.96 3:1 4725.8
【解析】
(1)在25℃、101KPa下,1gCH3OH与氧气充分反应,生成二氧化碳气体和水时释放出22.68kJ的热量,则1mol CH3OH与氧气充分反应,生成二氧化碳气体和水时释放出725.76kJ的热量,表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ/mol;
(2)葡萄糖的燃烧热是2804kJ/mol,可知葡萄糖的燃烧热的热化学方程式为C6H12O6(s)+6O2![]() 6CO2(g)+6H2O(l)△H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g 液态水时放出的热量是xg,
6CO2(g)+6H2O(l)△H=-2804kJ/mol,即生成108gH2O放出2804kJ的热量,设生成1g 液态水时放出的热量是xg,
可得:
![]() =
=![]() ;
;
解得:x=25.96kJ;
(3)①设混合气中H2的物质的量为x,则C3H8的物质的量为5mol-x.根据题意,列方程为:285.8kJ/mol×x+2220.0kJ/mol×(5mol-x)=3472.9kJ;
解得 x= 3.75mol;C3H8的物质的量为5mol-3.75mol=1.25mol;
所以混合气体中H2与C3H8的体积比即物质的量之比为3:1;
②1mol H2和2 mol C3H8组成的混合气体共完全燃烧时放热285.8kJ/mol×1mol +2220.0kJ/mol×2mol =4725.8kJ 。


科目:高中化学 来源: 题型:
【题目】在下列物质中:
①H2O②NH3③NH3H2O④乙醇⑤乙烯⑥CO2⑦CuSO45H2O⑧甲烷⑨H2O2
含非极性键的极性分子有( )
A.①②⑥B.③④⑦C.④⑨D.③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与硼(5B)同主族,与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素B.![]() 的中子数与电子数的差值为17
的中子数与电子数的差值为17
C.原子半径:In>AlD.碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分:
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | ⑧ | ||||||||||||||
Fe | |||||||||||||||||
Ⅰ.用化学用语回答下列问题:
(1)①、②、⑥形成的化合物中存在的化学键类型有________。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______。
(3)写出②的离子结构示意图为__________。
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。Y的水溶液与洁厕灵混合使用会产生一种有毒气体,该反应的离子方程式为_______。
Ⅱ.A、B、C、D都是中学化学中常见的物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
![]()
(1)若A是一种金属单质,C是淡黄色固体,写出C的一种用途_____;
(2)若A、B、C均为化合物且含有同一种金属元素,D是会造成温室效应的一种气体,请写出D的电子式_____,A和C反应的离子方程式 ___。
(3)若D是一种常见的过渡金属单质,原子核内有26个质子,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题:
(1)炒过菜的铁锅未及时洗浄(残液中含NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:铁锅的锈蚀应属于____________(填“析氢腐蚀”或“吸氧腐蚀”), 铁锅锈蚀的正极反应式为:____________。
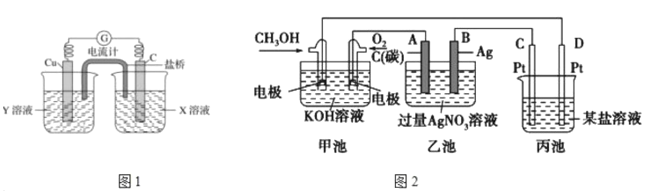
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如上图1所示原电池,回答下列问题:
①写出正极电极反应式___________
②图中X溶液中的溶质是____________
(3)如图2是一个电化学反应的示意图。
①写出通入CH3OH的电极的电极反应式_______________
②乙池中总反应的离子方程式_____________
③熔融盐CH3OH燃料电池用熔融碳酸钾为电解质,则电池负极反应式__________
④当乙池中B(Ag)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液H+的浓度是_____________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_____(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可通过下列流程回收废旧锂离子电池正极材料(LiCoO2,含少量Al、Fe)中的钴和锂。
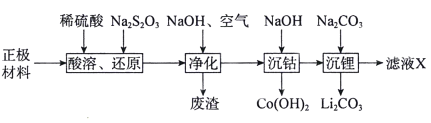
回答下列问题:
(1)“酸溶、还原”过程中S2O32-转化为SO42-,LiCoO2参与反应的离子方程式为____________________________________。
(2)“废渣”的主要成分为___________________。
(3)“沉钴”过程中,当溶液的pH=10时,c(Co2+)=______mol· L-1(已知常温下KSP[Co(OH)2]=1.58×10-15)。
(4)在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。

290℃时,完全脱水变为Co2O3,反应的化学方程式为_______________;500℃时的主要产物为_____________(填化学式);将1000℃时的分解产物1mol与2.2mol Na2O(稍过量)在充氩封闭管中共热,会生成鲜红色的晶体,该晶体的阴离子为正三角形结构,晶体的化学式为__________________。
(5)“滤液X”中最主要的溶质是_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含铁废铜制备胆矾的流程如下图所示:
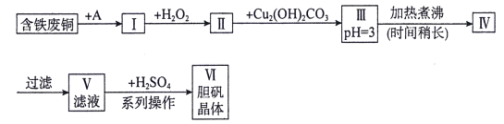
下列说法错误的是( )
A.物质A可选用盐酸
B.I中加H2O2的目的是溶解铜并将Fe2+氧化为Fe3+
C.长时间煮沸Ⅲ中悬浊液的目的是充分聚沉Fe(OH)3
D.“系列操作”包括蒸发浓缩,冷却结晶,过滤,洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
B.由C(石墨,s)![]() C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.化学变化不一定都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于化合反应的是
A.Zn+2AgNO3=Zn(NO3)2+2AgB.2FeCl2+Cl2=2FeCl3
C.Cu(OH)2+2HCl=CuCl2+2H2OD.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com