
 I���ɻ�β���е�NO���ƻ������㣮���ô�
I���ɻ�β���е�NO���ƻ������㣮���ô�| ʵ���� | T���棩 | NO��ʼŨ�ȣ�mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 1.20��10-3 | 124 | ||
| �� | 350 | 5.80��10-3 |
| c2(NO) |
| C(N2)��C(O2) |
 ��
��| 2mol |
| 2L |
| (10-1)mol |
| 2L |
| (5-1)mol |
| 2L |
| 1��1 |
| 4.5��2 |
| 1 |
| 9 |
| 1-x |
| 2 |
| x |
| 2 |
| y-1+x |
| 2 |
| ||||
|
| 1 |
| 9 |
|
| 9 |
| 11 |
| 1 |
| 9 |
| 9 |
| 11 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��֪ | ���� | |||||||||
| A | ��Fe����CuSO4��Һ�У�Fe+Cu2+=Cu+Fe2+ | ��Na���뵽CuSO4��Һ�У�2Na+Cu2+=Cu+2Na+ | ||||||||
| B | ϡ������Ba��OH��2��Һ��Ӧ����Һ�����ԣ�2H++SO42-+Ba++2OH-=BaSO4��+2H2O | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ�����ԣ�2H++SO42-+Ba++2OH-=BaSO4��+2H2O | ||||||||
| C | ����������Ӧ2Fe+3Cl2
|
���͵��ʷ�Ӧ2Fe+3I2
| ||||||||
| D | ��Ca��ClO��2��Һ��ͨ������CO2��Ca2++2ClO-+CO2+H2O=CaCO3��+2HClO | ��Ca��ClO��2��Һ��ͨ������SO2��Ca2++2ClO-+SO2+H2O=CaSO3��+2HClO |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| A����Ӧ�٢ڶ���������ԭ��Ӧ |
| B����Ӧ�����û���Ӧ |
| C����Ӧ����Ti02���������� |
| D����Ӧ����ÿ����1mol Tiת��4 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ˮ |
| B��Cl0��������ˮ |
| C�������ȥ���� |
| D��С�մ�����θ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||

| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������ϰ�װ��ת������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯������Ӧ�����������ʣ���������β����Ⱦ��
�������ϰ�װ��ת������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯������Ӧ�����������ʣ���������β����Ⱦ��
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO�� ����10-4mol?L-1�� |
10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c��CO�� ����10-3mol?L-1�� |
3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
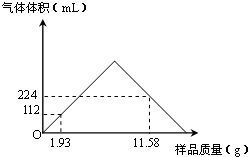 ������������ʵ���Һ�ҵ�����ж��й㷺����;��
������������ʵ���Һ�ҵ�����ж��й㷺����;��| 500-520�� |
| 1 |
| 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com