
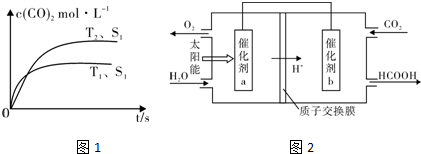
分析 (1)①化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
②根据“先拐先平数值大”知,T1>T2,升高温度二氧化碳浓度降低,说明平衡逆向移动;
③增大催化剂表面积,化学反应速率加快,反应达到平衡时间缩短,但催化剂不影响平衡移动,则二氧化碳浓度不变;
(2)①I.CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
II.2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
将方程式I-II得方程式CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),焓变进行相应的改变;
②根据图知,反应物是二氧化碳和水,生成物的甲酸和氧气,根据转移电子相等配平方程式;
a上失电子、b上得电子,电子从失电子的物质转移到得电子的物质中.
解答 解:(1)①化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,$K=\frac{{{c^2}(C{O_2})•c({N_2})}}{{{c^2}(C{O_{\;}})•{c^2}(N{O_{\;}})}}$,
故答案为:$K=\frac{{{c^2}(C{O_2})•c({N_2})}}{{{c^2}(C{O_{\;}})•{c^2}(N{O_{\;}})}}$;
②根据“先拐先平数值大”知,T1>T2,升高温度二氧化碳浓度降低,说明平衡逆向移动,则正反应是放热反应,△H<0,
故答案为:<;
③增大催化剂表面积,化学反应速率加快,反应达到平衡时间缩短,但催化剂不影响平衡移动,则二氧化碳浓度不变,其图象为 ,
,
故答案为: ;
;
(2)①I.CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
II.2NO2(g)?N2O4(g)△H=-56.9kJ•mol-1
将方程式I-II得方程式CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=(-867kJ•mol-1
)-(-56.9kJ•mol-1)=-810.1kJ•mol-1,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ•mol-1;
②根据图知,反应物是二氧化碳和水,生成物的甲酸和氧气,根据转移电子相等配平方程式为2CO2+2H2O$\frac{\underline{\;催化剂\;}}{\;}$2HCOOH+O2;
a上失电子、b上得电子,电子从失电子的物质转移到得电子的物质中,所以电子流向为a→b,
故答案为:2CO2+2H2O$\frac{\underline{\;催化剂\;}}{\;}$2HCOOH+O2;a→b.
点评 本题考查化学平衡计算、盖斯定律、化学平衡影响因素等知识点,明确化学反应原理是解本题关键,侧重考查学生分析判断能力,注意:催化剂只改变化学反应速率不影响平衡移动,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况,1molH2O含O原子个数为NA | |
| B. | 1.12L N2中含N2分子数为0.05NA | |
| C. | 5.6gFe与足量稀盐酸反应,转移的电子数为0.3NA | |
| D. | 0.1molFeCl3可制得Fe(OH)3胶体的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mi n | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
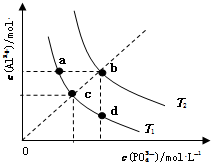
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的CCl4溶液不能使干燥红色布条褪色 | |
| B. | 通过化学变化可以实现16O与18O间的相互转化 | |
| C. | 为了便于运输和使用,可以将液氯储存在钢瓶(主要成分为铁)中 | |
| D. | 700℃时,4Na+CCl4=C+4NaCl,该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ | |
| B. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca2+═CaCO3↓ | |
| C. | 盐酸与氢氧化铁反应:3H++Fe(OH)3=Fe3++3H2O | |
| D. | NaOH溶液中加入醋酸:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液的本质区别是分散质颗粒的大小不同 | |
| B. | 氯化铁溶液可应急止血,利用的是胶体的聚沉 | |
| C. | 溶液是电中性的,胶体是带电的 | |
| D. | 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com