
下列变化必须加入还原剂才能发生的是:
A.CaCO3 → CO2 B.CO → CO2 C.CuO → Cu D.Na→ NaOH
科目:高中化学 来源: 题型:阅读理解
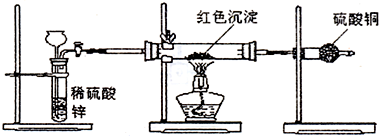
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
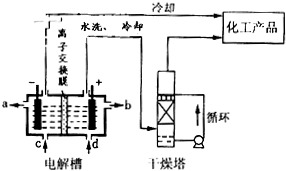
| ||
| ||
| △ |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:填空题
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
查看答案和解析>>
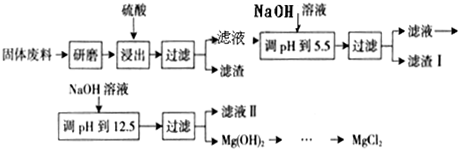
科目:高中化学 来源:2012-2013学年安徽省马鞍山市高三第三次教学质量检测化学试卷(解析版) 题型:填空题
钒的用途十分广泛,有金属“维生素”之称。某工厂为了从含有杂质的VOSO4样品中回收得到催化剂V2O5,设计流程如下:

请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式)。NH4VO3在焙烧前要洗涤2-3次,该步操作方法为 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(3)⑤的离子方程式为 。
(4)该工艺流程中,可以循环利用的物质有 和 。
(5)若取VOSO4样品wg,测得消耗a mol·L—1氯酸钾溶液VmL(氯酸钾还原产物为氯化钾),则1kg样品理论上可制得的V2O5质量是 g(用含w、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com