
如下图所示,烧杯中都盛有稀硫酸。

①写出(3)中的电极反应:Fe: 、 Zn: 。
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (填序号)。
科目:高中化学 来源:全国统一考试能力渗透测试卷——二轮专题检测 题型:058
某学生用圆底烧瓶、酒精灯、温度计、带塞导管(附尖嘴)、试管等仪器和碎瓷片组装成制取乙烯气体和试验乙烯性质的装置.根据此实验的原理和操作要求回答以下问题:
(1)写出加入药品时的操作要点:①________;②________.
(2)制取乙烯实验成败的操作关键是:________.
(3)反应后期反应混合物的颜色变化是:________;还可能发生的反应是(用化学方程式说明):________.
用如下图所示的仪器装置粗制乙酸乙酯.在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石;水浴加热.反应一段时间后,将粗产品倒入装有水烧杯中,液体分为两层.现用两种方法检验乙酸乙酯层和水层:第一种方法加入几滴![]() 溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果上层液体呈紫色.在该实验中:
溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果上层液体呈紫色.在该实验中:

(4)水浴的作用是________________,沸石的作用是________.
(5)冷凝水流经冷凝管时应从________,从________流出(填a或b).
(6)烧杯中乙酸乙酯在________层,根据是________;加入几滴![]() 溶液后,水层不显紫色是因为________,如果继续加入
溶液后,水层不显紫色是因为________,如果继续加入![]() 溶液,可以看到________,因为________.
溶液,可以看到________,因为________.
(7)粗制的乙酸乙酯经过提纯可得到较为纯净的乙酸乙酯,提纯的操作方法是________________.
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修1 4.1改善大气质量练习卷(解析版) 题型:实验题
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定___________________________________________________
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100 mL 5×10-4 mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,___________________________
第二步:___________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用如图所示简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4 mol/L的碘溶液,注入图中所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为________次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:__________________、______________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_________________________。
查看答案和解析>>
科目:高中化学 来源:山东省期中题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() 某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
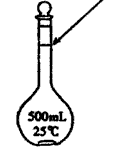
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
Ⅱ.测定中和热的实验装置如下图所示。
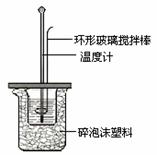
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g?℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)为测定某地空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定_________________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助同学完成100 mL 5×10-4 mol·L-1碘溶液的配制:
第一步:准确称取1.27 g碘单质加入烧杯中,________________;
第二步:______________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4mol·L-1的碘溶液,注入上图所示广口瓶中,加2—3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,抽气次数至少为_____次,方可说明该地空气中排放的SO2含量符合标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_____________________________________________________________________。
③丙同学认为:乙同学的实验方案抽气次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_______________________________________。
(3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用______________(选填a.浓硫酸 b.银氨溶液 c.新制的氢氧化铜 d.酸化的高锰酸钾溶液)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com