
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7 | |
| C. | pH为a的CH3COOH溶液和pH为b的NaOH溶液混合后溶液显酸性,则a一定大于b | |
| D. | 将10mLpH=a的盐酸与100 mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
分析 A、强酸和强碱的元数是否相等不明确,A、强酸强碱不一定是一元强酸和一元强碱;
B、一水合氨为弱碱,与等体积pH=12的氨水混合后,氨水有剩余;
C、酸溶液PH一定小于碱溶液的PH;
D.酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-).
解答 解:A、强酸强碱不一定是一元强酸和一元强碱,等浓度等体积混合可能酸过量或碱过量,故A错误;
B.与等体积pH=12的氨水混合后,氨水有剩余,溶液显碱性,混合后所得溶液pH>7,故B错误;
C.pH为a的CH3COOH溶液和pH为b的NaOH溶液混合后溶液显酸性,a一定小于b,故C错误;
D.氯化氢和氢氧化钡都是强电解质,酸碱恰好中和,则盐酸中n(H+)等于氢氧化钡中n(OH-),所以10-a mol/L×0.01L=1014-bmol/L×0.1L,则a+b=13,故D正确;
故选D.
点评 本题考查混合溶液酸碱性的判断及pH的有关计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,根据pH的计算公式及弱电解质电离特点进行分析解答.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 发展清洁能源 | B. | 增加植被面积 | C. | 燃烧煤炭供热 | D. | 选择绿色出行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤的反应类型相同 | B. | ⑥⑦的反应类型不同 | ||
| C. | ④与其他8个反应的类型都不同 | D. | ①③⑧属于同一种反应类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
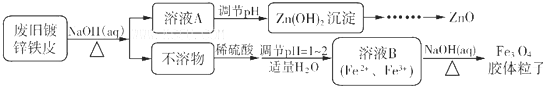
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n (N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 从反应开始到20s时,NO2的平均反应速率为0.15 mol•L-1min-1 | |
| B. | 达平衡后,混合气体的平均摩尔质量为69g/mol | |
| C. | 达平衡后,若升高温度器气体颜色变深,则可推知升高温度后反应平衡常数K减小 | |
| D. | 达平衡后,如向该密闭容器中再充入0.32 mol He气,并把容器体积扩大为4L,则平衡将向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
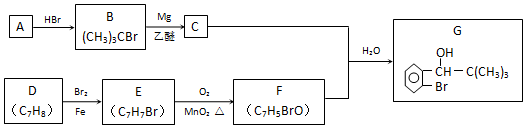

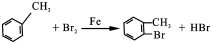 ;F的结构简式为
;F的结构简式为 .
.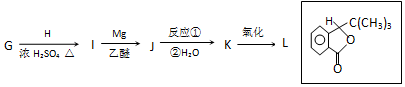
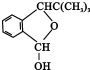 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
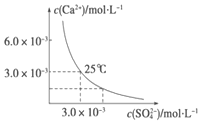 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100mL的CaSO4饱和溶液中,加入200mL 0.03mol•L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)( )| A. | 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 | |
| B. | 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| C. | 溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小 | |
| D. | 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) | |
| D. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com