
【题目】螺环化合物是指分子中两个环共用一个碳原子的化合物。甲、乙、丙三种有机物的结构如图所示。
甲: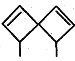 乙:
乙: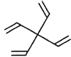 丙:
丙: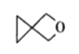
下列说法中正确的是
A.甲、乙、丙都属于螺环化合物
B.丙是环氧乙烷(![]() )的同系物
)的同系物
C.甲、乙互为同分异构体
D.甲、乙、丙分子中所有碳原子均处于同一平面
【答案】C
【解析】
A.根据定义,甲和丙有两个环共用一个C的结构,属于螺环化合物,乙不含两个环共用一个C的结构,不是螺环化合物,A错误;
B.环氧乙烷(![]() )结构中有一个环醚结构,丙(
)结构中有一个环醚结构,丙( )结构中除环醚结构还有一个环状结构,二者结构不相似,不互为同系物,B错误;
)结构中除环醚结构还有一个环状结构,二者结构不相似,不互为同系物,B错误;
C.甲和乙分子式都为C9H12,但结构式不同,二者互为同分异构体,C正确;
D.甲中: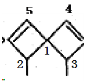 2、3、4、5号C原子与1号C原子形成正四面体结构,2、3、4、5号C原子最多只有2个与1号C原子共面。同理,乙中:
2、3、4、5号C原子与1号C原子形成正四面体结构,2、3、4、5号C原子最多只有2个与1号C原子共面。同理,乙中: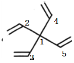 ,与1号C原子相连的4个C原子顶多有2个与1号C原子共面,丙中;
,与1号C原子相连的4个C原子顶多有2个与1号C原子共面,丙中; ,与1号C原子相连的4个C原子顶多有2个与1号C原子共面,故甲、乙、丙分子中所有碳原子均不可能处于同一平面,D错误。
,与1号C原子相连的4个C原子顶多有2个与1号C原子共面,故甲、乙、丙分子中所有碳原子均不可能处于同一平面,D错误。
答案选C。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景。
(1)可用Pt/Al2O3、Pd/C、Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2(g)+CO(g)CH3OH(g) ΔH<0
①如表所列数据是各化学键的键能,该反应的ΔH=______(用含字母的代数式表示)。
化学键 | H-H | C≡O | C-H | C-O | O-H |
键能/(kJ/mol) | a | b | c | d | e |
②在一定条件下,将1 molCO和2 molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

X轴上a点的数值比b点_________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______________。
(2)用CO2和H2合成甲醇:3H2(g) + CO2(g)CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 | |
起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
平衡数据 | c(CH3OH)/molL-1 | c1 | c2 | c3 |
反应的能量变化/kJ | x | y | z | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
①甲容器20s达到平衡时测得x=29.4,则甲中平均反应速率v(CO2)=______。
②下列说法错误的是________(填字母编号)。
A.2c2<c3 B.z>2y C.p3<2p1 D.α1+α3=1
(3)甲醇与水蒸气重整可以制氢。已知:
甲醇分解反应:CH3OH(g)CO(g) + 2H2(g) ΔH1=+90.64 kJ·mol-1
水蒸气变换反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-41.20 kJ·mol-1
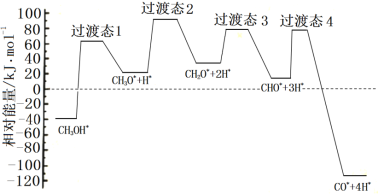
①科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最大的反应方程式为______________。
②573.2K时,向一刚性密闭容器中充入5.00MPaCH3OH使其分解,th后达平衡时容器中压强变为10.00MPa,其平衡常数分压Kp =_________。
③在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2 O)=1:1.3的混合气体充入一刚性密闭容器中反应。实验测得水煤气变换反应的速率随温度的升高明显下降,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(l)基态铁原子的价电子轨道表达式(电子排布图)为____________________________;在基态Ti2+中,电子占据的最高能层具有的原子轨道数为____________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+___Fe3+(填“大于”或“小于”),原因是___________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)______________。
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为___________。
A.  B.
B.  C.
C.  D.
D. 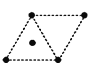
(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
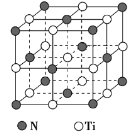
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为__________;
Ti原子与跟它次邻近的N原子之间的距离为____________。
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为____________。(用a、b表示)
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子得到的电子数目等于碳原子失去的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%-5%的D,其转化关系如下图所示。
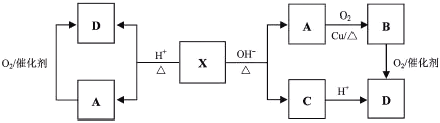
请回答:
(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)下列说法不正确的是________。
A.A+D→X的反应属于取代反应
B.除去X中少量D杂质可用饱和Na2CO3溶液
C.A与金属钠反应比水与金属钠反应要剧烈得多
D.等物质的量的A、B、D完全燃烧消耗O2的量依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
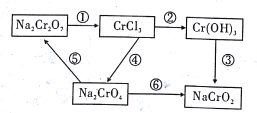
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在不同物质的同种元素之间的是
A.2H2S + SO2=3S↓ + 2H2O
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.CuO + H2SO4=CuSO4 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下述实验现象,下列氯水对应结论不正确的是
实验 | 装置 | 试剂 A | 现象 |
① |
| 紫色石蕊溶液 | 先变红后褪色 |
② | 滴有 KSCN 的 FeCl2 溶液 | 溶液变红 | |
③ | NaHCO3 溶液 | 产生使澄清石灰水变浑浊的气体 | |
④ | HNO3 酸化的 AgNO3 溶液 | 产生白色沉淀 |
A.①氯水具有酸性和漂白性
B.②氯水具有还原性
C.③氯水中含有 H+
D.④氯水中含有 Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com