
| A. | +54.5 kJ/mol | B. | -218 kJ/mol | C. | -54.5 kJ/mol | D. | +218 kJ/mol |
分析 7g CO的物质的量n=$\frac{m}{M}$=$\frac{7g}{28g/mol}$=0.25mol,由盖斯定律可知,反应CO+FeO═Fe+CO2可由$\frac{①×3-(②+③×2)}{6}$得到,以此来计算反应热.
解答 解:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);△H=-24.8kJ/mol,
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H=-47.2kJ/mol.,
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H=+640.5kJ/mol.由盖斯定律可知,$\frac{①×3-(②+③×2)}{6}$得到反应CO+FeO═Fe+CO2,
所以其反应热△H=$\frac{(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.4kJ/mol)×2}{6}$=-218kJ/mol,7g CO的物质的量n=$\frac{m}{M}$=$\frac{7g}{28g/mol}$=0.25mol,对应的△H=-218kJ/mol×0.25=-54.5 kJ/mol,
故选C.
点评 本题考查利用盖斯定律计算反应热,熟悉已知反应与目标反应的关系是解答本题的关键,题目难度不大.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标况下,22.4LSO3含有σ键数目为3NA | |
| B. | 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则某容器内加入0.5 NA个N2(g)与足量的H2(g),充分反应后放出的热量为46 kJ | |
| C. | 标准状况下,22.4L氦气含有的原子数为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤④⑤② | B. | ③⑤② | C. | ③⑤①② | D. | ③⑤①⑤② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gCH4含有5NA个电子 | |
| B. | 1mol Na与足量乙醇完全反应,失去2NA电子 | |
| C. | 1L 0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| D. | 标准状况下,22.4L苯含有约NA个C6H6分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氢原子的电子云图中,每个小黑点代表一个电子 | |
| B. | 某基态原子3d能级中电子排布的情况可能为 | |
| C. | 电子构型为[Ar]3d104s2的元素是过渡金属元素 | |
| D. | 当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
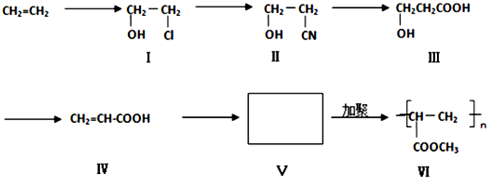
 CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$
CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$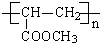 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com