
| | 实验操作 | 实验目的 |
| A | 将乙醇滴加到酸性KMnO4或K2Cr2O7溶液中 | 证明乙醇具有氧化性 |
| B | 向苯酚的饱和溶液中滴加稀溴水 | 制备三溴苯酚 |
| C | 向乙醚和苯酚的混合液中加入足量NaOH,蒸馏 | 除去乙醚中的苯酚 |
| D | 将试样溶于水配成溶液,先后加入AgNO3溶液 | 鉴别食盐与亚硝酸钠 |
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸测得某地水的pH为5.2 |
| B.用10mL量筒量取7.5mL的水 |
| C.用托盘天平称得某食盐样品的质量为16.7g |
| D.测得某粗盐中氯化钠的质量分数为90.5% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
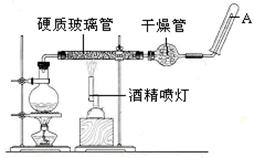
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KI淀粉溶液中通入Cl2,溶液变蓝原因是淀粉能与Cl2发生显色反应 |
| B.浓硝酸在光照条件下变黄是由于浓硝酸不稳定,生成有色物质能溶于浓硝酸 |
| C.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成说明该溶液中含有SO42- |
| D.常温下,浓硫酸可储存在铁质或铝制器皿中说明常温下铁和铝与浓硫酸不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com