
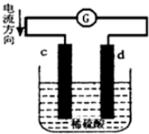
 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )| A. | c为负极,其质量逐渐减小,发生还原反应 | |
| B. | 当有0.2mol电子通过电路,正极表明产生气体2.24L | |
| C. | 电池工作的过程中,溶液中SO42-浓度逐渐减小 | |
| D. | 当负极质量减轻32.5g时,烧杯中溶液中H+的浓度为2mol/L |
分析 根据图象知,c是负极、d是正极,Zn易失电子作负极、Cu作正极,所以c是Zn、d是Cu,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电池工作的过程中,硫酸根离子的物质的量不变,结合电子守恒解答.
解答 解:据图象知,c是负极、d是正极,Zn易失电子作负极、Cu作正极,所以c是Zn、d是Cu,负极反应式为 Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,
A.c为锌片,锌失去电子导致其质量逐渐减小,但是锌发生氧化反应,故A错误;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.电池工作的过程中,硫酸根离子不反应,所以溶液中SO42-浓度基本不变,故C错误;
D.32.5gZn的物质的量为:$\frac{32.5g}{65g/mol}$=0.5mol,0.5mol锌完全反应失去1mol电子,根据电子守恒,参与反应的氢离子的物质的量为1mol,氢离子浓度变化为:$\frac{1mol}{0.5L}$=2mol/L,原溶液中氢离子浓度为4mol/L,则此时氢离子浓度为:4mol/L-2mol/L=2mol/L,故D正确;
故选D.
点评 本题考查原电池原理,题目难度不大,侧重考查学生对电流方向与电极正负极的关系是解本题关键,注意掌握原电池工作原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 广告称“某品牌的八宝粥(含桂圆、红豆、糯米)不加糖,比加糖还甜,适合糖尿病人食用.”这个广告有误导喜爱甜食消费者的嫌疑,因为不加糖不等于没有糖,糖尿病人食用需慎重 | |
| B. | 用食用醋除去热水瓶中积存的水垢 | |
| C. | 用灼烧闻气味的方法区分化纤织物与纯毛织物 | |
| D. | 用米汤检验加碘盐中的碘酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
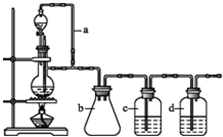 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2S溶液中含有0.2NA个Na+ | |
| B. | 标准状况下,22.4L的H2O含有2NA个氢原子 | |
| C. | 常温下,44gCO2含有NA个氧原子 | |
| D. | 0.1molNa与足量O2反应生成Na2O,转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cl2发生还原反应 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com