
| A. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用KMnO4溶液 | |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| D. | 将铜粉加1.0 mol•L-1Fe2(SO4)3溶液中,溶液变蓝,有黑色固体出现,说明金属铁比铜活泼 |
分析 A.氢氧化铝不溶于弱碱;
B.铁离子具有还原性,可与高锰酸钾等氧化剂反应;
C.氧化铝的熔点高,包裹在Al的外面;
D.Cu与Fe2(SO4)3溶液发生氧化还原反应生成硫酸铜、硫酸亚铁.
解答 解:A.氢氧化铝不溶于弱碱,所以向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.亚铁离子具有还原性,可与高锰酸钾等发生氧化还原反应,高锰酸钾溶液褪色,可鉴别,故B正确;
C.氧化铝的熔点高,包裹在Al的外面,则Al熔化但不滴落,现象不合理,故C错误;
D.Cu与Fe2(SO4)3溶液发生氧化还原反应生成硫酸铜、硫酸亚铁,现象不合理,不能有黑色固体出现,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意元素化合物知识与实验的结合.


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 可用25mL酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 用pH计测得某溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 营养均衡是人体健康的保证.
营养均衡是人体健康的保证.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾中铁显+6价 | |
| B. | Fe3+的氧化性强于FeO42- | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | 用K2FeO4处理废水时其转化为Fe3+,因此K2FeO4具有杀菌和吸附双重作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
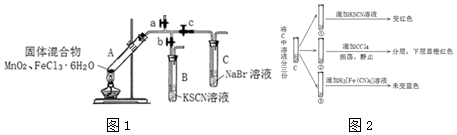
| 操作步骤 | 现象 |
| 1检查装置气密性,添加相应药品,点燃酒精灯,开始给A加热 | |
| 2打开a,关闭b、c,用湿润蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
| 3打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
| 4打开c,关闭a、b | C中溶液变棕黄色 |
| 5停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通过Na2O2使其增重28 g 时,反应中转移的电子数为0.5NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则 Ba SO4饱和溶液中Ba2+数目为=1×10-5 NA | |
| C. | 标准状况下,22.4 L CH2Cl2中共价键的数目为4NA | |
| D. | 高温下,16.8g Fe与足量的水蒸气完全反应失去电子的数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +HNO3$\stackrel{浓硫酸}{→}$
+HNO3$\stackrel{浓硫酸}{→}$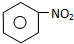 +H2O;③
+H2O;③ ;④
;④ .①③④均为取代反应(填反应类型).
.①③④均为取代反应(填反应类型). E
E .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL0.1mol•L-1硝酸银溶液中加入1mL0.1mol•L-1NaC1溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com