
分析 (1)反应焓变为负值的属于放热反应,焓变为正值的反应是吸热反应,燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,燃烧10gH2生成液态水,依据热化学方程式计算得到,2H2(g)+02(g)═2H20(1)△H=-570kJ/mol;
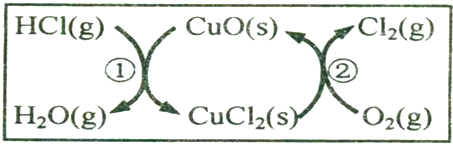
(2)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,根据盖斯定律(①+②)×2可得总反应的热化学方程式.
解答 解:(1)①2H2(g)+02(g)═2H20(1)△H=-570kJ/mol;
②H20(g)═H2(g)+$\frac{1}{2}$02(g)△H=+241.8kJ/mol;
③C(s)+02(g)═C02(g)△H=-393.5KJ/moL.
反应中①③反应属于放热反应,依据反应③C(s)+02(g)═C02(g)△H=-393.5KJ/moL可知,C的燃烧热为393.5KJ/moL,燃烧10gH2生成液态水,氢气物质的量=$\frac{10g}{2g/mol}$=5mol,依据热化学方程式计算
2H2(g)+02(g)═2H20(1)△H=-570kJ/mol;
2 570KJ
5mol Q
Q=1425KJ,
故答案为:①③;393.5KJ/moL;1425KJ;
(2)由图示可知,整个过程为:4HCl+O2=2Cl2+2H2O,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,
反应②生成1molCl2(g)的反应热为△H2,则反应热化学方程式为:CuCl2(g)+$\frac{1}{2}$O2(g)=CuO(s)+Cl2(g)△H2,
根据盖斯定律(①+②)×2可得总反应的热化学方程式:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2),所以2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H=△H1+△H2,
故答案为:△H1+△H2.
点评 本题考查了热化学方程式的书写方法,燃烧热概念和热化学方程式的计算应用,题目较简单.


科目:高中化学 来源: 题型:解答题
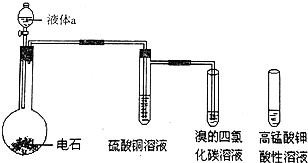 如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略.
如图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验目的 |
| A | 将一定质量的FeCl3固体加入沸水中 | 配制FeCl3溶液 |
| B | 将一定质量的TiCl4加入大量热水中,充分反应后,过滤,洗涤 | 制取TiO2•xH2O |
| C | 将两个完全相同且充满NO2的密闭烧瓶,分别浸泡于热水、冰水中 | 探究温度对化学平衡状态的影响 |
| D | 将适量溴水加入KI溶液中,振荡,再加入CCl4,振荡,静置 | 验证Br2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
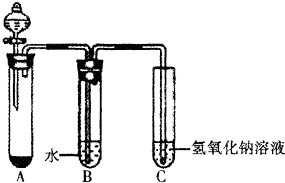 某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).
某课外小组同学用下图所示装置进行C12的制备及相关性质实验(加热及夹持装置已省略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 | |
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H20+O2+4e-═4OH- | |
| C. | 在轮船底镶嵌锌块以保护船体,利用的是牺牲阳极保护法 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.4 g | B. | 8.4 g | C. | 4.1g | D. | 9.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com