
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
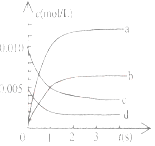
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
【答案】K=c2(NO2)/[c2(NO).c(O2)]Cb0.0015mol/(L.s)BC
【解析】
:(1)可逆反应2NO(g)+ O2(g)![]() 2NO2(g)的平衡常数K=c2(NO2)/[c2(NO).c(O2)],根据已知 K300℃>K350℃,说明升高温度平衡向逆反应移动,故正反应是放热反应△H <0,又因为反应后气体变少,所以△S<0;因此C符合题意。答案是: K=c2(NO2)/[c2(NO).c(O2)] C;
2NO2(g)的平衡常数K=c2(NO2)/[c2(NO).c(O2)],根据已知 K300℃>K350℃,说明升高温度平衡向逆反应移动,故正反应是放热反应△H <0,又因为反应后气体变少,所以△S<0;因此C符合题意。答案是: K=c2(NO2)/[c2(NO).c(O2)] C;
(2)由方程式2NO(g)+ O2(g)![]() 2NO2(g)和图像可以知道,平衡时浓度的变化量△c(NO) : △c(O):△c(NO2)=2:1:2,由表中数据可以知道,平衡时△c(NO)=(0.02mol-0.007mol)/2L=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,
2NO2(g)和图像可以知道,平衡时浓度的变化量△c(NO) : △c(O):△c(NO2)=2:1:2,由表中数据可以知道,平衡时△c(NO)=(0.02mol-0.007mol)/2L=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,
由图中数据可以知2s内NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)= 0.006mol.L-1 /2s=0.003mol/(L.s) ,根据速率之比等于化学计量数之比,故v(O2)=1/2 v(NO)=1/2![]() =0.0015mol/(L.s),因此,本题答案是:b; 0.0015mol/(L.s)。
=0.0015mol/(L.s),因此,本题答案是:b; 0.0015mol/(L.s)。
(3)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故A错误;B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,所以B选项是正确的;C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆 (NO)=2v正 (O2),说明到达平衡,而v (NO)=2v(O2)不能说明到达平衡,所以C选项是错误的;D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故D错误;所以B选项是正确的。
(4)因为2NO(g)+O2(g)![]() 2NO2(g) K300℃>K350℃,所以正反应是放热反应适当升高温度,反应速率增大,平衡向逆反应移动,故A不符合题意;B.选择高效的催化剂,增大反应速率,不影响平衡移动,故B不符合题意;C.增大O2的浓度,反应速率增大,平衡向正反应移动,所以C选项正确; D.充入He(g),使体系总压强增大,但不影响分压,平衡混合物中各组分的浓度保持不变,故平衡不移动,D不符合题意;所以答案为C。
2NO2(g) K300℃>K350℃,所以正反应是放热反应适当升高温度,反应速率增大,平衡向逆反应移动,故A不符合题意;B.选择高效的催化剂,增大反应速率,不影响平衡移动,故B不符合题意;C.增大O2的浓度,反应速率增大,平衡向正反应移动,所以C选项正确; D.充入He(g),使体系总压强增大,但不影响分压,平衡混合物中各组分的浓度保持不变,故平衡不移动,D不符合题意;所以答案为C。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于野外焊接钢轨的原料,F与D同主族。
(1)D、E、F的离子半径由大到小的顺序为_______________________(填离子符号)。
(2)F和G形成的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,该反应的化学方程式为___________________。
(3)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为__________。常温下,液体乙与气体丙反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为________________。
(4)现取100 mL1 mol/L的E的氯化物溶液,向其中加入1 mol/L NaOH溶液产生了3.9g沉淀,则加入的NaOH溶液体积可能为_________________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验时所用的铂丝,每次用毕后都要
A.用水多洗几次
B.先用稀盐酸洗,再用水洗
C.用稀盐酸洗,再在火焰上灼烧到没有什么颜色为止
D.放在火焰上灼烧,直到铂丝发红为止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”“偏
小”“无影响” )。
(4)倒入NaOH溶液的正确操作是_________________________,使盐酸与NaOH溶液混合均匀的正确操作是___________________________。平行地做一次这样的实验需要测定_____次温度。
(5)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为①2.3 ℃,②2.4 ℃,③2.9 ℃,则最终代入计算式的温度差的平均值为________ ℃。已知水的比热容为C为4.18J/(g·℃),稀盐酸和稀氢氧化钠溶液的密度别为ρ1、ρ2用量均为VmL,混合前溶液的平均温度为t1,混合溶液的最高温度为t2,则中和热ΔH=____________________ kJ/mol(请写出简化的代数式,否则不给分)。
(6)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_______________。(填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示![]() 或
或![]() ]随pH的变化关系如图所示。下列说法不正确的是
]随pH的变化关系如图所示。下列说法不正确的是

A. 直线I中X表示的是![]()
B. 直线I、Ⅱ的斜率均为1
C. c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D. c(Na+)=c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计方案一定可行的是( )
A.用水鉴别苯和四氯化碳
B.用降温结晶的方法除去KNO3中混有少量的NaCl
C.用分液的方法分离碘的四氯化碳溶液
D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3) = 3。下图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法错误的是

A. 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-)
B. 25℃时,H2CO3的一级电离平衡常数Ka1= 10-6
C. 25℃时,CO2饱和溶液的浓度是0.05 mol·L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH 约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为1%
D. 25℃时,0.1 mol·L-1,的Na2CO3和0.1 mol·L-1的NaHCO3混合溶液中离子浓度的大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:

(1)0~8 min,v(CO2)=__________mol·L-1·min-1。
(2)该反应在恒温恒容的密闭容器中进行,能说明该反应达到化学平衡状态的是_____
A、单位时间内 ,每消耗1molCO2同时生成1molCO
B、容器内气体的压强不再随时间变化
C、容器内气体的密度不再随时间变化
D、容器内气体的平均相对分子质量不再随时间变化
(3)计算该温度下,反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数__________
FeO(s)+CO(g)的平衡常数__________
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填序号)。
A、温度 B、铁粉的量(足量) C、压强 D、CO的量
(5)已知:反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
②根据表中数据,计算反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com