
【题目】

(1)图I是实验室制取蒸馏水的常用装置,图中明显的错误是_________________。
(2)仪器A的名称是_____________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量__________,其作用是_________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
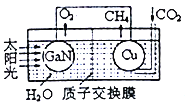
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积、体积为2 L的密闭容器中充入1 mol N2和3 mol H2发生反应,当反应进行到10 s末时反应达到平衡,此时容器中c(NH3)=0.1mol·L-1。下列有关判断错误的是
A.反应达平衡时N2的转化率为10%
B.反应进行到10 s末时,H2的平均反应速率是0.03 mol·(L·s)-1
C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
D.该反应达到平衡时的压强是起始时压强的0.95倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应:X(g)+2Y(g) ![]() 2Z(g) △H=-a kJ·mol-1,达到化学平衡时,则下列说法中不正确的是:
2Z(g) △H=-a kJ·mol-1,达到化学平衡时,则下列说法中不正确的是:
A. 该反应可能放出a kJ热量 B. 各物质浓度c(X) : c(Y) : c(Z)肯定不变
C. X与Y的物质的量肯定之比为1 : 2 D. 容器中肯定同时存在X、Y、Z三种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是:

A. 电池工作时,CO32-向电极A移动
B. 电极A上H2参与的电极反应:H2-2e-=2H+
C. 电极B上发生电极反应:O2+2CO2+4e-=2CO32-
D. 反应CH4+H2O=3H2+CO,每消耗22.4 L CH4气体,转移6 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸能量关系如图。下列说法不正确的是:

A. 相同条件下,HCl的△H2比HBr的小
B. 已知HF气体溶于水放热,则HF的△H1>0
C. 相同条件下,HCl的△H3+△H4与HI的一样大
D. 一定条件下气态原子生成1 mol H-X键放出a kJ能量,则该条件下△H2=a kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:

已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是______________,H中的官能团名称是________________________。
(2)由D生成E的反应类型是__________,G的结构简式为________________________。
(3)B+C→D的化学方程式为______________。
(4)L是F的同分异构体,含有联苯结构,遇FeCl3溶液显紫色,则L有__________________(不考虑立体异构)种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为______。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选) __。
的合成路线(其他无机试剂任选) __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为____________,①的反应类型为____________,②的反应类型为____________。
(2)富马酸的结构简式为______________。
(3)检验富血铁中是否含有Fe3+的实验操作步骤是________________________________________。
(4)写出下列反应的化学方程式:
①_____________________________________________________________。
④______________________________________________________________。
⑥_______________________________________________________________。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____ L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________________________________(写出结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com