
| ��Ŀ | ���ȱ� | β�� | ��ȷ������ | ��ʧ���� |
| ����ʧ����kg/t�� | 13 | 24.9 | 51.3 | 89.2 |
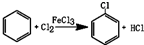
���� ��1��������B����Һ���£�װ����ѹǿ����ʱ����������ƽ����ѹ����ȡ����ԭ��ͨ������ˮ��
��2���ٷ�Ӧ��C���ȿ��Ʒ�Ӧ�¶���40-60�棬Ӧ����ˮԡ���ȣ�
�����ڱ��ӷ�����Ӧ������HCl������δ��Ӧ��������������D���ڵ�����
��3�������Ȼ������������Ʒ�Ӧ�����ɵ�HCl�����������Ʒ�Ӧ���ܽ������Ҳ����ȥ�����Ʒ�Ӧ��
��4��A��C��Ӧ��֮����Ҫ��������װ�ã��������ɵ������������������������Ȼ��Ƶȣ�
��5�����ݱ�������ʧ������μӷ�Ӧ�ı����������ٸ��ݱ����ȱ��������ȹ�ϵ���㣮
��� �⣺��1��������B����Һ���£�װ����ѹǿ����ʱ����������ƽ����ѹ����ȡ����ԭ��ͨ������ˮ��ʹ�����ܳ�������ˮ�������ȴ��������ˮ��a�����룬��b��������
�ʴ�Ϊ��ƽ����ѹ��a��
��2���ٷ�Ӧ��C���ȿ��Ʒ�Ӧ�¶���40-60�棬Ӧ����ˮԡ���ȣ�
�ʴ�Ϊ��c��
�����ڱ��ӷ�����Ӧ������HCl������δ��Ӧ��������D���������к���HCl����������������
�ʴ�Ϊ����������������
��3�������Ȼ������������Ʒ�Ӧ������HCl�����������Ʒ�Ӧ���ܽ������Ҳ����ȥ�����Ʒ�Ӧ����Ӧ����ʽΪ��FeCl3+3NaOH=Fe��OH��3��+3NaCl��HCl+NaOH=NaCl+H2O��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��FeCl3+3NaOH=Fe��OH��3��+3NaCl��HCl+NaOH=NaCl+H2O�ȣ�
��4��A��C��Ӧ��֮����Ҫ����U�ܣ��������ɵ������������������������Ȼ��Ƶȣ�
�ʴ�Ϊ�������������Ȼ��ƣ�
��5����������ʧ��Ϊ89.2kg/t����1t���вμӷ�Ӧ�ı�������Ϊ��1t-0.0892t�����ɱ����ȱ�����֮��Ϊ78��112.5����֪�����ȱ�����Ϊ$\frac{��1-0.0892����112.5}{78}$t��
�ʴ�Ϊ��$\frac{��1-0.0892����112.5}{78}$��
���� ���⿼���л����Ʊ�ʵ�鷽������Ŀ�Ѷ��еȣ��漰��װ�á�������ԭ���ķ������۵�֪ʶ����ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ�������������ѧ���ķ�����������ѧʵ��������


 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��չѭ�����ã�������Դ��Լ����ἰ��������������� | |
| B�� | ����ɫ��ѧ�������գ����������Ѻ��ͻ�����ϵ | |
| C�� | ����������������Դ���ƹ�ʹ���Ҵ����ʹ��洫ͳ��ȼ�� | |
| D�� | ��ƻ�ѧʵ�鷽��ʱ���ᳫ�þ����ܶ����Ʒ���Լ������ʵ��Ч�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | X | Y | Z |
| ��ʼŨ��/mol•L-1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A�� | ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50% | |
| B�� | ��Ӧ�ɱ�ʾΪX+3Y?2Z��ƽ�ⳣ��Ϊ1600 | |
| C�� | ������������ʱ������ѹǿ��ʹƽ�ⳣ������ | |
| D�� | �ı��¶ȿ��Ըı�÷�Ӧ��ƽ�ⳣ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һa�д��ڳ����ܽ�ƽ�⣺AgCl��s��?Ag+��aq��+Cl-��aq�� | |
| B�� | ��Һb�в�����Ag+ | |
| C�� | ������ɫ�仯˵��AgClת��ΪAgI | |
| D�� | ʵ�����֤��AgI��AgCl������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�AgCl �ڱ��� NaCl ��Һ�е� KSP ���ڴ�ˮ�е� KSP С | |
| B�� | �� AgCl ������Һ�м��� KI ��Һ�������ɰ�ɫת��Ϊ��ɫ | |
| C�� | �� 0.001 mol•L-1 �� AgNO3 ��Һ���� KCl �� KI �Ļ����Һ�У�һ���Ȳ��� AgI ���� | |
| D�� | �� AgCl �ı�����Һ�м��� NaCl ���壬�� AgCl ��������Һ�� c��Ag+��=c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A�� | ��Ӧ��ǰ50 s��ƽ������Ϊv��PCl3��=0.0016mol•L-1•s-1 | |
| B�� | ���������������䣬�����¶ȣ�ƽ��ʱ��c��PCl3��=0.11mol•L-1����Ӧ�ġ�H��0 | |
| C�� | ��ͬ�¶��£���ʼʱ�������г���1.0 molPCl5��0.20 molPCl3��0.20 molCl2���ﵽƽ��ǰv��������v���棩 | |
| D�� | ��ͬ�¶��£���ʼʱ�������г���2.0 molPCl3��2.0 molCl2���ﵽƽ��ʱ��PCl3��ת����С��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
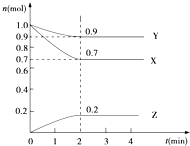 ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��
ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
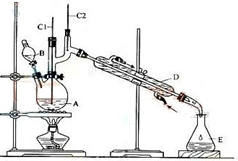 ����ȩ��һ�ֻ���ԭ�ϣ�ijʵ��С��������ͼװ�úϳ�����ȩ��
����ȩ��һ�ֻ���ԭ�ϣ�ijʵ��С��������ͼװ�úϳ�����ȩ��| �е�/�� | �ܶ�/��g•cm-3�� | ˮ���ܽ��� | |
| ������ | 117.72 | 0.8109 | �� |
| ����ȩ | 75.7 | 0.8017 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com