
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多
B.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣Q1 kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=﹣Q2 kJ/mol,则Q1>Q2
D.已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ
【答案】C
【解析】解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8KJ/mol,故B错误;
O2(g)═H2O(l)△H=﹣285.8KJ/mol,故B错误;
C.H2O(g)→H2O(l)为放热过程,2molH2(g)和1mol O2(g)反应生成2mol H2O(l)时放出的热量多,即Q1>Q2,故C正确;
D.浓硫酸稀释过程中放出热量,所以放出的热量大于57.3kJ,故D错误;
故选C.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表 格中“乙”应填写 .
(2)【测定 H2C2O4xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000molL﹣1 的 KMnO 标准溶液进行滴定;
请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是(选填 a、b).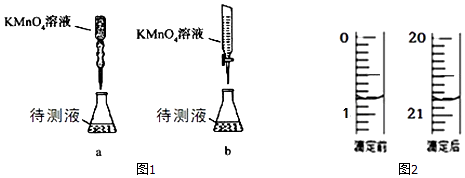
(4)由图2可知消耗 KMnO4溶液体积为mL;
(5)滴定过程中眼睛应注视;
(6)通过上述数据,求得 x= . 以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。不正确的操作顺序是
A.⑤②④①③B.⑤④②①③C.②⑤④①③D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照①-⑨在表中的位置,回答下列问题:(用元素符号或化学用语回答)

(1)由①②⑧三种元素形成的常见化合物的电子式为_____,其包含的化学键类型为_____(填“离子键”、“共价键”)。
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程______________。
(3)③④⑤三种元素分别形成的简单离子,离子半径由大到小的顺序是____________。
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点___(填“高”或“低”),理由_____________。
(5)元素⑥的单质和④的最高价氧化物的水化物之间发生反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的佛点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
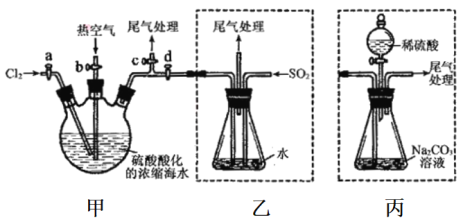
①连接甲与乙,关闭活案b、d,打开活案a、c,向甲中缓慢通入Cl2至反应结束。
②关闭a、c,打开b、d,向甲中鼓入足量热空气。
③进行步骤②的同时,向乙中通入足量SO2。
④关闭b,打开a,再通过甲向乙中级慢通入足量Cl2。
⑤将乙中所得液体进行蒸馏,收集液溴。
请回答:
(1)步骤②中鼓入热空气作用为____________。
(2)步骤③中发生的主要反应的离子方程式为___________。
(3)此实验中尾气可用____(填选项字母)吸收处理。
A.水 B.饱和Na2CO3溶液 C.NaOH溶液 D.饱和NaCl溶液
(4)若直接连接甲与丙进行步骤①和②,充分反应后,向维形瓶中满加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,丙中反应生成了NaBrO3等,该反应的化学方程式为______。
(5)与乙装置相比,采用丙装置的优点为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.pH=2的溶液中:S2O32﹣、K+、Cl﹣、Na+
B.![]() =10﹣10 mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
=10﹣10 mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在 ![]() =1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

回答下列问题:已知:①酯能被LiAlH4还原为醇
②
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
(5)参照上述合成路线,写出用甲醇和苯甲醇为原料制备化合物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验: 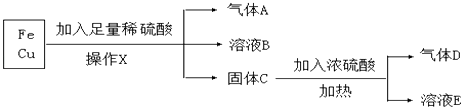
(1)操作X的名称是;
(2)气体D是;
(3)A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
(4)溶液B中的金属阳离子是 , 溶液E中阴离子除了OH﹣外还有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com