
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |


科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D、电池充电过程中,KOH的物质的量浓度将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫化钠溶液中加入足量稀硝酸:S2-+2H+=H2S↑ | ||||
| B、往氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓ | ||||
C、用惰性电极电解饱和食盐水:2Cl-+2H2O
| ||||
D、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaH是离子化合物,则NaH的电子式为Na:H |
| B、碘-131是一种放射性元素,其简单阴离子的核外电子数为53 |
| C、等物质的量的HCl和NaCl中分子数相等 |
| D、核素A与核素B的质量数相等,中子数不相等,它们一定不是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、上述正反应为吸热反应 | ||
| B、在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
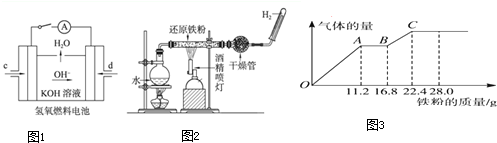
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com