
(1)氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
①配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
②若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
已知:4NH3+O2 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3
(2)设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
①a mol NO完全转化为HNO3理论上需要氧气_____________mol。
②为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________
(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
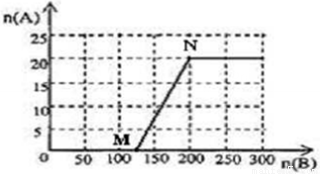
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。

(本题共16分)(1)①18.68mL ②C
(2)①0.75a ②0.14
(3)7.5%;97.5%
(4)
【解析】
试题分析:(1)①根据c=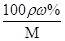 可知,浓氨水的物质的量浓度c=
可知,浓氨水的物质的量浓度c=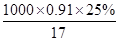 mol/L=13.4mol/L。设浓氨水的体积为V,则2.5mol/L×0.1L=13.4mol/L×V,解得V=0.01868L=18.68mL。
mol/L=13.4mol/L。设浓氨水的体积为V,则2.5mol/L×0.1L=13.4mol/L×V,解得V=0.01868L=18.68mL。
②若两种氨水等质量混合,则混合后氨水的质量分数等于15%。等体积的两种氨水,浓度大的氨水的密度较小,所以质量较小,两种氨水混合后,质量分数更接近稀氨水的浓度,因此所得氨水溶液的质量分数小于15%,因此答案选C。
(2)①根据化学反应方程式4NO+3O2+2H2O→4HNO3可知,a mol NO完全转化为HNO3理论上需要氧气=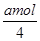 ×3=0.75amol。
×3=0.75amol。
②假设氨气的体积是4L,设需要空气的体积为y,则根据化学反应方程式可知
4NH3
+ 5O2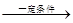 4NO+6H2O
4NO+6H2O
4L 5L
4L 0.20y
解得y=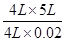 =25L
=25L
所以氨-空气混合物中氨的体积分数=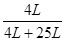 =0.14
=0.14
(3)设生成x mol HNO3,根据反应式4NH3+5O2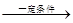 4NO+6
H2O、4NO+3O2+2H2O→4HNO3可知NH3+2O2→HNO3+H2O,由于空气中氮气的量是氧气的4倍,所以4(2x+18.0×
4NO+6
H2O、4NO+3O2+2H2O→4HNO3可知NH3+2O2→HNO3+H2O,由于空气中氮气的量是氧气的4倍,所以4(2x+18.0×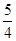 +12.0)=150.0,解得x=1.5mol。根据氮原子守恒,NH3的转化为HNO3的转化率=
+12.0)=150.0,解得x=1.5mol。根据氮原子守恒,NH3的转化为HNO3的转化率=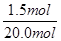 ×100%=7.5%;NH3的转化为NO的转化率=
×100%=7.5%;NH3的转化为NO的转化率=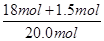 ×100%=97.5%。
×100%=97.5%。
(4)根据反应4NH3+5O2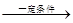 4NO+6
H2O①和4NO+3O2 +2H2O→4HNO3②可知,将(①+②)÷2得到反应NH3+2O2→H2O+HNO3③。由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为
4NO+6
H2O①和4NO+3O2 +2H2O→4HNO3②可知,将(①+②)÷2得到反应NH3+2O2→H2O+HNO3③。由①③知,当n(O2):n(NH3)≤5:4,即n(空气):n(NH3)≤25:4时无硝酸生成,此时20.0mol氨气所需空气量为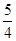 ×20.0mol×5=125mol;当5:4≤n(O2):n(NH3)≤2:1,即25:4≤n(空气):n(NH3)≤10:1时有硝酸生成,此时20.0mol氨气所需空气量为5×2××20.0mol=200mol,生成硝酸的物质的量是20mol,所以HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线为
×20.0mol×5=125mol;当5:4≤n(O2):n(NH3)≤2:1,即25:4≤n(空气):n(NH3)≤10:1时有硝酸生成,此时20.0mol氨气所需空气量为5×2××20.0mol=200mol,生成硝酸的物质的量是20mol,所以HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线为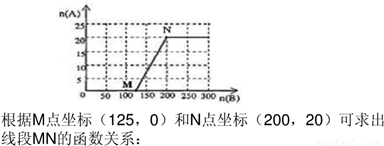 。
。
考点:考查氨水的物质的量浓度、氨气催化氧化以及制备硝酸计算和图像识别等


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| 制备NH3 | 干燥 | 化学方程式 | ||
| 仪器 | 药品 | 仪器 | 药品 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
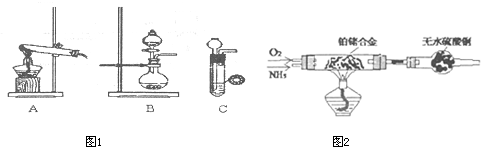
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
| ||
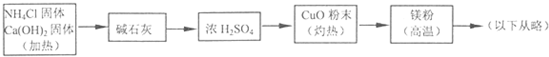
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省唐山市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
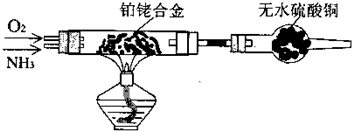
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:填空题
氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
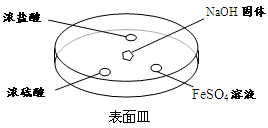
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和 。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com