
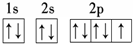
分析 (1)O原子核外有8个电子,分别位于1s、2s、2p轨道,1s、2s、2p轨道电子数分别是2、2、4;
(2)Fe是26号元素,其原子核外有26个电子,铁原子失去2个电子生成Fe2+,其3d轨道上6个电子为其外围电子;
(3)原子核外有几个电子,其原子核外电子就有几种运动状态;
(4)35号元素是Br元素,其原子核外有35个电子,根据构造原理书写其简化电子排布式;
(5)Mn是25号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p63d54s2,其3d、4s电子为其外围电子.
解答 解:(1)O原子核外有8个电子,分别位于1s、2s、2p轨道,1s、2s、2p轨道电子数分别是2、2、4,其核外电子排布图为 ,故答案为:
,故答案为: ;
;
(2)Fe是26号元素,其原子核外有26个电子,铁原子失去2个电子生成Fe2+,其3d轨道上6个电子为其外围电子,其价电子排布式为3d6,故答案为:3d6;
(3)原子核外有几个电子,其原子核外电子就有几种运动状态,基态X原子中的电子共有7种不同的空间运动状态,则X原子核外有7个电子,为N元素,其2s、2p电子为其价层电子,所以其价层电子排布式为2s22p3,故答案为:2s22p3;
(4)35号元素是Br元素,其原子核外有35个电子,根据构造原理知其简化电子排布式为[Ar]3d104s24p5,
故答案为:[Ar]3d104s24p5;
(5)Mn是25号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p63d54s2,其3d、4s电子为其外围电子,其外围电子排布式为3d54s2,故答案为:3d54s2.
点评 本题考查原子核外电子排布,为高频考点,明确构造原理、能量最低原理、洪特规则、保里不相容原理等内涵是解本题关键,注意:原子失电子时先失去最外层电子.


科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 称量固体氢氧化钠时应在天平两边托盘上各放一张大小相同的同种质量的纸 | |
| C. | 进行分液时,下层液体从分液漏斗下口流出,上层液体应从上口倒出 | |
| D. | 蒸馏时温度计水银球应位于被蒸馏的液体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 根据图①可判断可逆反应 A2(g)+3B2(g)?2AB3(g) 的△H>0 | |
| B. | 图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 图④是N2与H2合成氨的能量变化曲线,则1 mol N2和4 mol H2充分反应时放热一定小于92 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的腐蚀一定伴有电流产生 | |
| B. | Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀 | |
| C. | 发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀 | |
| D. | 发生电化学腐蚀时都有能量的转变,且被腐蚀的金属总是失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①是氨气发生装置 | B. | ②是氨气吸收装置 | ||
| C. | ③是氨气发生装置 | D. | ④是氨气收 集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )与氢溴酸在硫酸催化下反应而得.在100-106℃下反应1.5h,蒸馏,将蒸馏液用水洗涤后,加5%~7%碳酸钠溶液调节pH=8~9,分液,加无水氯化钠,蒸馏,收集118~122℃馏分而得产品.
)与氢溴酸在硫酸催化下反应而得.在100-106℃下反应1.5h,蒸馏,将蒸馏液用水洗涤后,加5%~7%碳酸钠溶液调节pH=8~9,分液,加无水氯化钠,蒸馏,收集118~122℃馏分而得产品.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com