
| 4-(-1) |
| 2×[0-(-1)] |
| 100×103L×a×10-3g |
| 26g/mol |
| 50a |
| 13 |
| 50a |
| 13 |
| 50a |
| 13 |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
| A、1.79×10-20 kJ |
| B、3.59×10-20 kJ |
| C、1.08×104kJ |
| D、2.16×104kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验内容 | 实验目的或实验结论 |
| A | 向盛有2mL 0.1mol/L AgNO3溶液的试管中滴加5滴0.1mol/L NaCl溶液,有白色沉淀生成,再向其中滴加5滴0.1mol/L KI溶液 | 说明一种沉淀能转化为溶解度更小的沉淀 |
| B | 向1mL 20% 的蔗糖溶液中加入3~5滴稀硫酸,水浴加热5min,冷却后再加入新制Cu(OH)2悬浊液,加热 | 证明蔗糖能发生水解反应 |
| C | 水浴加热浓硝酸、浓硫酸和苯的混合物后,直接蒸馏分液后得到的粗产品 | 制备纯硝基苯 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
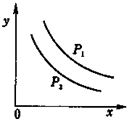 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量一定相同 |
| B、所含分子数一定相同 |
| C、所含原子数一定相同 |
| D、气体体积一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
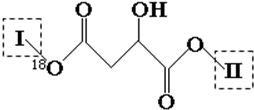
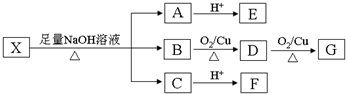

| Cl2 |
| 催化剂 |
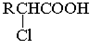 ;RCH2Br
;RCH2Br| ①NaCN |
| ②H2O/H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com