
【题目】(1)某气态烃的摩尔质量为16g/mol,该烃中氢元素的质量分数为25% ,则该烃的分子式为_______________结构式为________ ,空间构型为__________ ,在光照条件下该烃和氯气反应生成气态有机物的反应方程式为___________________________________________ ,反应类型为 _________
(2)化学式为C8Hm的烷烃,m值等于______;CnH22的烷烃,n值等于_______;相对分子质量为212的烷烃的分子式为___________。
【答案】 CH4 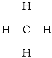 正四面体 CH4+C12
正四面体 CH4+C12![]() CH3C1+HCl 取代反应 18 10 C15H32
CH3C1+HCl 取代反应 18 10 C15H32
【解析】(1)根据摩尔质量结合元素含量计算分子式,据此解答;
(2)根据烷烃的通式CnH2n+2解答。
(1)某气态烃的摩尔质量为16g/mol,该烃中氢元素的质量分数为25%,则该烃分子中氢原子个数是![]() ,因此碳原子个数是
,因此碳原子个数是![]() ,所以分子式为CH4,为甲烷分子,则结构式为
,所以分子式为CH4,为甲烷分子,则结构式为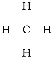 ,空间构型为正四面体。一氯甲烷是气体,则在光照条件下该烃和氯气发生取代反应生成气态有机物的反应方程式为CH4+C12
,空间构型为正四面体。一氯甲烷是气体,则在光照条件下该烃和氯气发生取代反应生成气态有机物的反应方程式为CH4+C12![]() CH3C1+HCl;
CH3C1+HCl;
(2)烷烃的通式CnH2n+2,化学式为C8Hm的烷烃,则m=8×2+2=18;CnH22的烷烃中n=![]() ;相对分子质量为212的烷烃,则14x+2=212,解得x=15,所以该烷烃的分子式为C15H32。
;相对分子质量为212的烷烃,则14x+2=212,解得x=15,所以该烷烃的分子式为C15H32。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于电解法精炼铜的下列说法正确的是( )
A. 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液
B. 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液
C. 电解结束后,溶液中Cu2+浓度不变
D. 电解结束后,溶液中Cu2+浓度变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+ , 然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则: 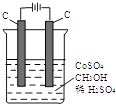
Co2+在阳极的电极反应式为:;除去甲醇的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据: Fe(s)+ ![]() O2(g)═FeO(s)△H=﹣272kJmol﹣1
O2(g)═FeO(s)△H=﹣272kJmol﹣1
2Al(s)+ ![]() O2(g)═Al2O3(s)△H=﹣1675kJmol﹣1
O2(g)═Al2O3(s)△H=﹣1675kJmol﹣1
则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
A.+859 kJmol﹣1
B.﹣859 kJmol﹣1
C.﹣1403 kJmol﹣1
D.﹣2491 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)SiO44-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是________。
②与SiO44-互为等电子体的微粒符号是______(任写一种)。
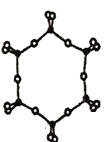
③下图为一种硅氧组群的结构示意图,其离子符号为______,其中Si原子的杂化方式为____。
④电负性:Si______O(填“>”、“=”或“<”) 。
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
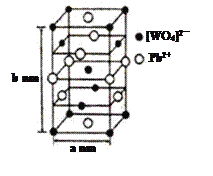
①PWO中钨酸根结构式式为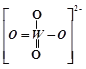 ,该离子中δ键和π键的个数比是______。
,该离子中δ键和π键的个数比是______。
②PWO晶体中含有的微粒间作用力是______(填标号)。
A.范德华力 B.离子键
C.共价键 D.金属键
③己知晶体的摩尔质量为Mg·mol-1,则该晶体的密度d=_______g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯的一种同位素,下列说法不正确的是( )
A.35Cl原子所含质子数为18
B.35Cl2气体的摩尔质量为70
C.3.5g的35Cl2气体的体积为2.24L
D.1/18mol的H35Cl分子所含中子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com