
分析 (1)计算NO物质的量,再计算NO2、N2O4总物质的量,气体全部为NO、NO2时,得到硝酸最少,气体为NO、N2O4时得到硝酸最多,结合N原子守恒计算;
(2)根据c=$\frac{1000ρω}{M}$计算98%浓硫酸密度、87%硫酸的物质的量浓度,再根据稀释定律计算吸水后硫酸体积,进而吸收水的质量;
(3)根据蒸馏过程中硝酸、硝酸镁质量不变,表示出蒸馏后97.5%的HNO3的质量、60%的Mg(NO3)2溶液质量,蒸馏后溶液质量之和=原溶液质量之和-损耗水的质量;
(4)根据N原子守恒计算n(NaNO3),NO、NO2和NaOH溶液反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,结合方程式计算原混合气体中NO和NO2的物质的量,再根据氧原子守恒解答.
解答 解:(1)NO的物质的量为1.25mol×0.6=0.75mol,则NO2、N2O4总物质的量为1.25mol-0.75mol=0.5mol,
气体全部为NO、NO2时,得到硝酸最少,根据N原子守恒,得到硝酸极小值为1.25mol,
气体为NO、N2O4时得到硝酸最多,根据N原子守恒,得到硝酸极大值为0.75mol+0.5mol×2=1.75mol,
则:1.25mol<n(HNO3)<1.75mol,
故答案为:1.25mol<n(HNO3)<1.75mol;
(2)98%浓硫酸密度为$\frac{18.4×98}{1000×98%}$g/mL=1.84g/mL,
87%(密度1.8g/cm3)的硫酸物质的量浓度为$\frac{1000×1.8×87%}{98}$mol/L,
根据稀释定律,50mL浓硫酸吸水失去吸水能力后溶液体积为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$=57.57mL,
则吸收水的质量为:$\frac{50mL×18.4mol/L}{\frac{1000×1.8×87%}{98}mol/L}$×1.8g/mL-50mL×1.84g/mL=11.63g
故答案为:11.63;
(3)蒸馏后得到97.5%的HNO3的质量为$\frac{{m}_{1}×65%}{97.5%}$,得到60%的Mg(NO3)2溶液质量为$\frac{{m}_{2}×72%}{60%}$,损耗水的总质量为(m1+m2)×5%,则:
$\frac{{m}_{1}×65%}{97.5%}$+$\frac{{m}_{2}×72%}{60%}$=(m1+m2)-(m1+m2)×5%
整理可得:$\frac{{m}_{1}}{{m}_{2}}$=0.88
故答案为:0.88;
(4)根据N原子守恒得n(NaNO3)=n(NOx)-n(NaNO2)=0.5mol-0.35mol=0.15mol,
由 2NO2+2NaOH=NaNO2+NaNO3+H2O,可知生成0.15mol硝酸钠需要0.3molNO2,同时生成0.15mol亚硝酸钠,则反应NO+NO2+2NaOH=2NaNO2+H2O生成的亚硝酸钠为0.35mol-0.15mol=0.2mol,则该反应中消耗0.1molNO2、0.1molNO,所以原混合气体中NO、NO2的物质的量分别是0.1mol、0.4mol,尾气中NO与NO2的平均组成记为NOx,则x=$\frac{0.1mol×1+0.4mol×2}{0.5mol}$=1.8,
故答案为:1.8.
点评 本题考查混合物有关计算、溶液浓度计算,题目计算量大,属于易错题目,有利于培养学生的分析计算能力,注意极限法与守恒法的应用,难度中等.


科目:高中化学 来源: 题型:解答题
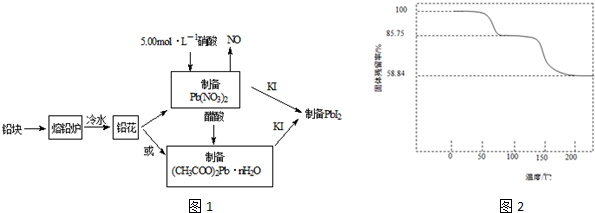
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有食品添加剂的物质均对人体健康有害 | |
| B. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同素异形体 | B. | H、D、T互为同位素 | ||
| C. | CH3-CH3与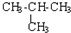 互为同系物 互为同系物 | D. | 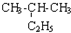 与 与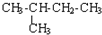 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷可与氯气反应制取纯净的一氯乙烷 | |
| B. | 乙烯可以使溴水褪色 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烯制备聚乙烯是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
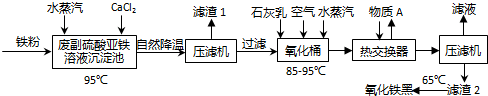
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
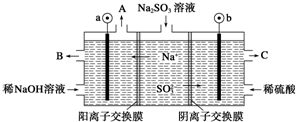
| A. | 图中a极连接电源的负极 | |
| B. | A口放出的物质是氢气,C口放出的物质是氧气 | |
| C. | b极电极反应式为:SO32--2e-+H2O═SO42-+2H+ | |
| D. | 电解过程中阴极区碱性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
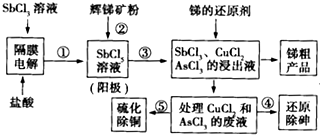 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)═2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com