
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.加入KSCN溶液一定会变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如下图所示的反应关系。下列物质组不满足上述转化关系的是( )

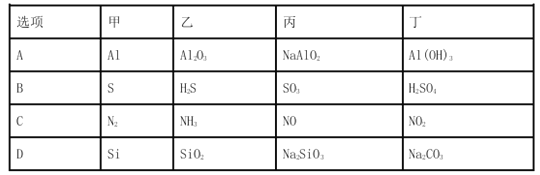
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
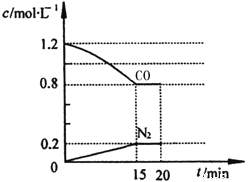
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2mol/L NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
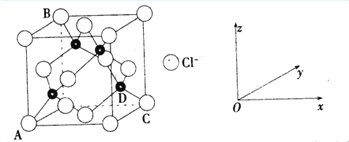
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A.CO32-+H2O![]() HCO3-+OH-:用热的纯碱溶液清洗油污
HCO3-+OH-:用热的纯碱溶液清洗油污
B.A13++3H2O![]() AI(OH)3(胶体)+3H+:明矾净水
AI(OH)3(胶体)+3H+:明矾净水
C.SnCl2+H2O![]() Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液
D.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+3H+:制备TiO2纳米粉
TiO2·xH2O↓+3H+:制备TiO2纳米粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【河北省定州中学2017届高三下学期开学考试】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A. v(甲)>v(乙)>v(丙)
B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙)
D. v(乙)>v(甲)>v(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com