
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
B. pH=1的H3PO4溶液中,含有0.1NA个H+
C. 0.1mol Fe在足量氧气中燃烧,转移电子数为0.3NA
D. 1L 0.1mol·L-1的NH4Cl溶液中含有NH4+数目为0.1NA
【答案】A
【解析】
A.100g 46%的乙醇溶液有46g(1mol)CH3CH2OH和54g(3mol)H2O,每分子乙醇中含有1个O-H键,则1molCH3CH2OH含H-O键的数目为NA,每分子水中含有2个O-H键,则3molH2O含H-O键的数目为6NA,合计含H-O键的数目为7NA,A正确;
B.pH=1,则c(H+)=0.1mol/L,但溶液的体积不知道,无法求氢离子的个数,B错误;
C.0.1mol Fe在足量氧气中燃烧得到Fe3O4,铁元素由0价变为+![]() 价,因而转移电子数为0.1mol×
价,因而转移电子数为0.1mol×![]() NA≈0.27NA,C错误;
NA≈0.27NA,C错误;
D.铵根水解方程式为NH4++H2ONH3·H2O+H+,若氯化铵中铵根不水解,则易算出溶液中含有NH4+数目为0.1NA,但铵根部分水解,数目减少,因而实际溶液中含有NH4+数目小于0.1NA,D错误。
故答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写不正确的是
A. 用铜电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
C. 向Ba(OH)2溶液中加入NaHSO4至溶液为中性:Ba2++2OH-+2H++![]()
![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用O2氧化HCl转化成Cl2,提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:
2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
c(Cl2)/10-3molL-1 | 0 | 1.8 | 3.7 | 5.4 | 7.2 | 7.2 |
下列说法错误的是( )
A.条件不变时,12min时v正(Cl2)=v逆(H2O)
B.2.0~4.0min内的平均反应速率大于6.0~8.0min内的
C.0~8.0min内HCl的平均反应速率为1.8mol·L-1·min-1
D.加入高效催化剂,达到平衡所用时间小于8.0min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入1molCH3COOCH3(l)和1molC6H13OH(l)发生反应:CH3COOCH3(l)+C6H13OH(l) ![]() CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。
CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。

回答下列问题:
(1)CH3COOCH3的一种同分异构体属于酸,它的结构简式为___。
(2)己醇(C6H13OH)中,含3个甲基的结构有___种(不考虑立体异构)。
(3)M点:正反应速率___逆反应速率(填“大于”“小于”或“等于”,下同)。N点正反应速率___M点逆反应速率。
(4)上述反应在0~5min内CH3COOCH3的平均反应速率为___mol·min-1。
(5)上述反应达到平衡时,C6H13OH的转化率为___%。
(6)N点混合物中CH3COOC6H13的物质的量分数为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:

(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
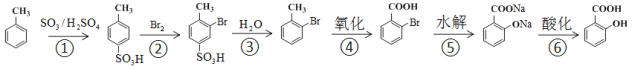
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
③以烃A为原料,合成聚甲基丙烯酸的路线如下:
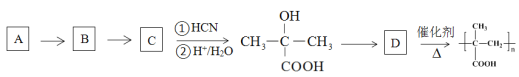
已知:
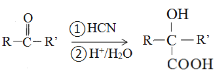
(R、R’为烃基或氢原子)
请填写有机物A~D的结构简式,在所有箭头上标注试剂和条件_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用浓H2SO4配制480mL 0.2mol·L-1的稀H2SO4。
(1)需要量取98%密度为1.84g·cm-3的浓硫酸________mL。
(2)配制时,必须使用的仪器有______(填代号),还缺少的仪器是_________、_________。
①烧杯;②10mL量筒;③20mL量筒;④托盘天平(带砝码);⑤玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是________________、_______________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”、“无影响”)。
①容量瓶没有干燥________,
②用量筒量取98%的硫酸溶液时俯视________,
③溶液转移到容量瓶后,未进行洗涤操作_________ ,
④定容时俯视容量瓶__________,
⑤如果加水超过了刻度线,取出水使液面恰好到刻度线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和砷均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为________。同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为________________。
(2)Na3AsO3中所含阴离子的立体构型为___________,写出一个与AsO33-具有相同空间构型和键合形式的分子____________________(填化学式)。
(3)在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为__________,_________;1mol尿素分子中,![]() 键的数目为___________。
键的数目为___________。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是__________________。
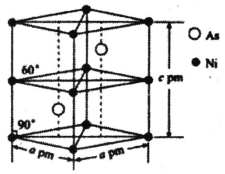
(5)某砷镍合金的晶胞结构如图所示,阿伏加德罗常数的值为NA,则该晶体的密度![]() =________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
=________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
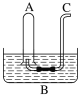
(1)将A倒插入B槽中发生反应的化学方程式为_______________________________________,该反应中氧化剂与还原剂的质量比为________,原混合气体中NO2和NO的物质的量之比为________。
(2)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为________ mol·L1(设溶液的体积仍为500 mL)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com