
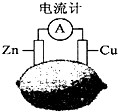
| A. | 该装制能将电能转换为化学能 | B. | 电子由铜片流出经导线到锌片 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧产生Cu2+使柠檬变蓝色 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
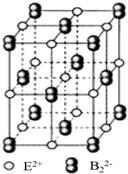 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.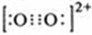 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
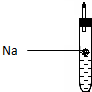 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂组成 | 1 | 2 | 3 |
| WO3 W α-Fe2O3 | 65% 5% 30% | 65% 10% 25% | a b 20% |
| 六价铬去除率 | 60.2% | 80% | 72.9% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
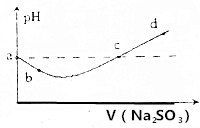
| A. | a点表示的溶液中存在3种分子,3种离子 | |
| B. | b点溶液中不存在SO2 | |
| C. | c点溶液中c(Na+)=2c(HSO3-)+2c(SO32-) | |
| D. | d点溶液中不存在HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com