
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
分析 A.过滤时要防止滤纸破损;
B.从蒸馏时温度计的作用的角度考虑;
C.分液时要避免液体重新混合而污染;
D.用玻璃棒搅拌来使液体受热均匀.
解答 解:A.过滤时要防止滤纸破损吗,搅拌能戳坏滤纸,故A错误;
B.蒸馏时,温度计用来测量馏分的温度,应靠近蒸馏烧瓶的支管口处,故B正确;
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可防止液体重新混合而污染,故C正确;
D.在蒸发液体时为了防止液体局部过热而引起液体的飞溅,而用玻璃棒搅拌来使液体受热均匀,故D正确.
故选A.
点评 本题考查常见物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关实验方法、原理和注意事项,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
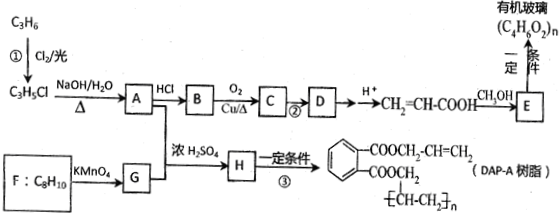
 ;
;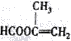 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
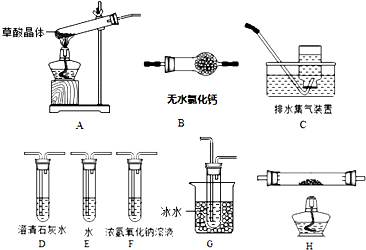
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z两元素形成的简单阴离子的还原性Z>Y | |
| B. | 原子半径大小的顺序为Z>X>Y>W | |
| C. | X与W形成的化合物W2X2中含有离子键和共价键 | |
| D. | Y、Z两种元素最高价氧化物的水化物的酸性Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com