
 .
. ,R→S的化学方程式为
,R→S的化学方程式为 .
.
 .
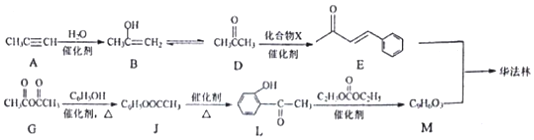
. 分析 (1)A中含有碳碳三键,属于炔烃,故可知A→B是丙炔与H2O发生加成反应;
(2)利用D、E的结构简式知E是D与X(苯甲醛)发生反应生成E与H2O,苯甲醛可与新制氢氧化铜浊液发生氧化还原反应生成苯甲酸与砖红色氧化亚铜沉淀、水,反应溶液为碱性,因此生成苯甲酸又与碱反应生成苯甲酸盐,由此可知X(苯甲醛)与新制氢氧化铜浊液反应的化学方程式;
(3)G为乙酸酐,G与苯酚生成J同时,还生成乙酸,乙酸中含有的官能团是-COOH;
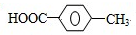
(4)Q→R是苯环上的甲基上的1个H原子被取代,R→S是氯代烃的水解反应,S→T是-CH2OH变成-COOH,T的核磁共振氢谱只有两组峰,说明2个羧基处在苯环的对位,Q为对甲基苯甲酸,据此解答;
(5)苯酚可与甲醛缩合成体型高分子化合物;
(6)L→M是取代反应,由①的反应信息,-OH与C2H5OCOOC2H5反应,-COOC2H5与酚羟基H原子交换,由②的反应信息可知,发生自身交换生成M,故M的结构简式为: .
.
解答 解:(1)A中含有碳碳三键,属于炔烃,为丙炔,故可知A→B是丙炔与H2O发生加成反应,
故答案为:丙炔;加成反应;
(2)由结构简式可知E的分子式为C10H10O,由D、E的结构简式知E是D与X(苯甲醛)发生反应生成E与H2O,苯甲醛可与新制氢氧化铜浊液发生氧化还原反应生成苯甲酸与砖红色氧化亚铜沉淀、水,反应溶液为碱性,因此生成苯甲酸又与碱反应生成苯甲酸盐,由此可知X(苯甲醛)与新制氢氧化铜浊液反应的化学方程式为: ,
,
故答案为:C10H10O; ;
;
(3)G为乙酸酐,G与苯酚生成J同时,还生成乙酸,乙酸中含有的官能团是-COOH,G的分子式为C4H6O3,反应生成二氧化碳和水,1mol完全燃烧,消耗的氧气的物质的量为(4+$\frac{6}{4}$-$\frac{3}{2}$)mol=4mol,
故答案为:羧基;4;
(4)Q→R是苯环上的甲基上的1个H原子被取代,R→S是氯代烃的水解反应,S→T是-CH2OH变成-COOH,T的核磁共振氢谱只有两组峰,说明2个羧基处在苯环的对位,Q为对甲基苯甲酸,Q结构简式为 ,R为
,R为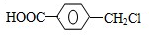 ,则R→S的化学方程式为:
,则R→S的化学方程式为:
故答案为: ;
; ;
;
(5)苯酚可与甲醛缩合成体型高分子化合物,检验酚羟基,可加入氯化铁溶液,溶液呈紫色,
故答案为:苯酚;氯化铁溶液,溶液呈紫色;
(6)L→M是取代反应,由①的反应信息,-OH与C2H5OCOOC2H5反应,-COOC2H5与酚羟基H原子交换,由②的反应信息可知,发生自身交换生成M,故M的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物的结构与性质、同分异构体以及方程式的书写,为高考常见题型,需要对给予的信息进行利用,该类试题能较全面地考查学生的有机化学基础知识和逻辑思维能力、创造思维能力,也有利于培养学生的自学能力和知识的迁移能力,题目难度掌握.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究铜在灼烧时出现的黑色物质可能是炭黑 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
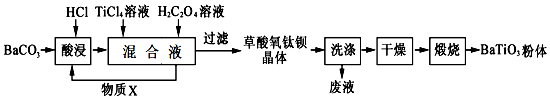
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热交换器 | B. | 沸腾炉 | C. | 吸收塔 | D. | 接触室 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、CO32- | B. | Br-、CO32-、Cl- | C. | CO32-、Br-、Cl- | D. | Br-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
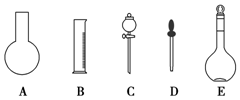 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com